Содержание
- 2. Общая характеристика углерода В. Углерод (Carboneum-рождающий уголь) 1. Характеристика по ПСХЭ. а) неметалл б) IV группа,
- 3. а) Z=+6 б) +1р=6 в) 0n=12-6=6 г) е=6 д) +6)2)4 2 2 2 е) 1S 2S
- 4. Аллотропные модификации углерода - алмаз, графит карбин.
- 5. бесцветное кристаллическое вещество с атомной решеткой. Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от
- 6. жирное на ощупь вещество черного или серого цвета с металлическим блеском, тугоплавок (плавится под давлением 105
- 7. Кристаллическая решётка графита для графита характерна гексагональная кристаллическая решетка. Состоит из параллельных слоев, образованных правильными шестиугольниками
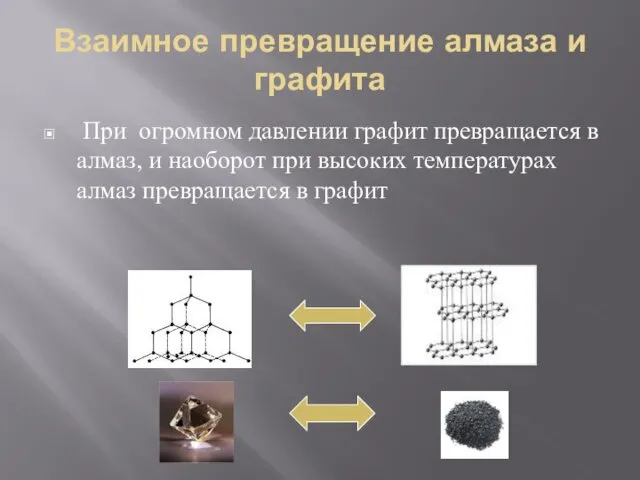
- 8. Взаимное превращение алмаза и графита При огромном давлении графит превращается в алмаз, и наоборот при высоких
- 9. Уголь Видоизменения графита, часто встречающиеся в природе- кокс, сажа, древесный уголь.
- 10. аллотропная модификация углерода. Представляет собой черный порошок. Карбин является полупроводником и его проводимость возрастает под действием
- 11. Адсорбция-свойство угля и других твёрдых веществ удерживать на своей поверхности пары, газы и растворённые вещества. Адсорбент-
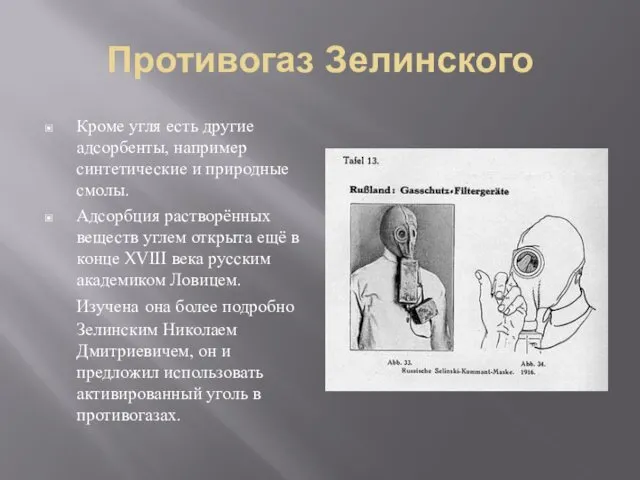
- 12. Противогаз Зелинского Кроме угля есть другие адсорбенты, например синтетические и природные смолы. Адсорбция растворённых веществ углем
- 13. Химические свойства. Cвойства окислителя: а) с металлами образует карбиды 4Al+3C=Al4C3 ( при нагревании) карбида алюминия получают
- 14. Свойства восстановителя в) восстанавливает металлы из их оксидов CuO + C = CO2 +Cu г) горит
- 15. Кремний и его соединения
- 16. Кремний по распространению в земной коре занимает 2-е место после кислорода (26 %) В природе встречается
- 17. Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. Кристаллическая решетка кремния напоминает структуру алмаза.
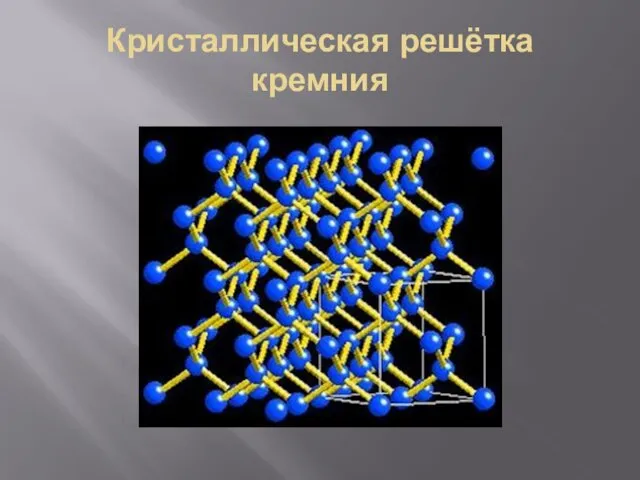
- 18. Кристаллическая решётка кремния
- 19. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен четырьмя другими и связан с
- 20. Структура связей атома кремния в кристаллической решетке
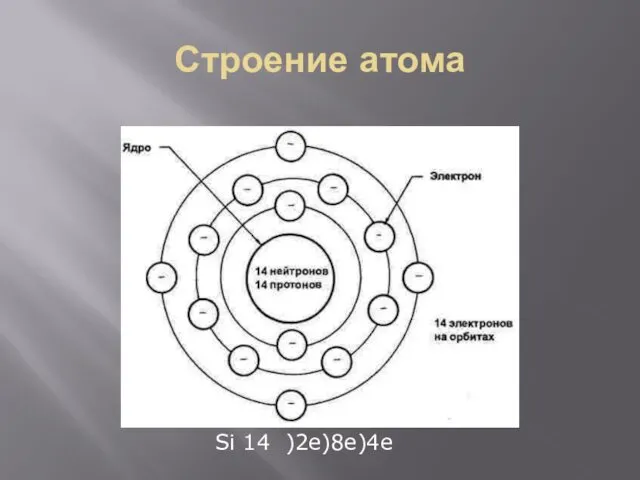
- 21. Строение атома Si 14 )2e)8e)4e
- 22. Соединения кремния 0 +4 +2 Примеры: Si, SiO2, SiO.
- 23. Физические свойства кремния Темно-серые, блестящие, непрозрачные кристаллы Хрупкий Твердый Тугоплавкий, Плохой проводник тока
- 24. Химические свойства кремния а) восстановительные 1) Si + O2 =SiO2 2) Si + 2CL2 = SiCL4
- 25. Методы получения кремния В промышленности кремний получают восстановлением кремнезема SiO2 коксом в электрических печах при 1500-17000С:
- 26. Применение кремния материал для электроники материал для сосудов; компонент сплавов с железом; - сверхчистый кремний –
- 27. Соединения кремния 1)Оксид кремния SiO2 (IV) называют также кремнеземом. Физические свойства: бесцветное, твердое тугоплавкое вещество (температура
- 28. Химические свойства оксида кремния (IV) Относится к кислотным оксидам: 1. При сплавлении его с твердыми щелочами,
- 29. 2. Реагирует со щелочами в растворе (образует ортосиликаты). Кип. SiO2 (ам.)+ 4NaOHNa4SiO4+ 2H2O 3. Взаимодействует только
- 30. 4. Восстанавливается углеродом, магнием, железом (в доменном процессе). Кип а) SiO2 + 3C(кокс)SiC+CO б)SiO2 + 2MgSi+
- 31. Силикаты Силикаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех силикатов - кремнекислородный
- 32. Применение силикатов в качестве жидкого стекла - концентрированных растворов силикатов калия и натрия; его используют: а)
- 34. Скачать презентацию



























 Соединения серы
Соединения серы Теория электролитической диссоциации
Теория электролитической диссоциации СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Химический элементы в нашей жизни
Химический элементы в нашей жизни Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Нефелометрический анализ
Нефелометрический анализ Мыла и синтетические моющие средства
Мыла и синтетические моющие средства Atmospheric chemistry
Atmospheric chemistry AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Углекислый газ - диоксид углерода
Углекислый газ - диоксид углерода Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические
Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические Железо. Строение атома, химические и физические свойства. Урок №1
Железо. Строение атома, химические и физические свойства. Урок №1 Валентные состояния атома углерода
Валентные состояния атома углерода Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Ювелирная работа – изысканный шедевр
Ювелирная работа – изысканный шедевр Соли аммония
Соли аммония Обмен липидов
Обмен липидов Ртуть. Применение ртути и ее соединений
Ртуть. Применение ртути и ее соединений Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Курс хімії за 11 клас
Курс хімії за 11 клас Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Этот многоликий цинк
Этот многоликий цинк Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Приложения II начала термодинамики
Приложения II начала термодинамики Кристаллические решетки
Кристаллические решетки