Содержание
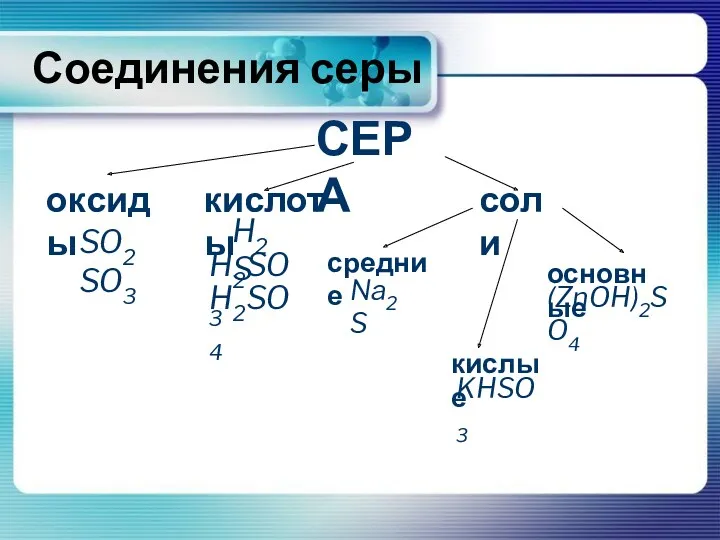
- 2. СЕРА соли Соединения серы
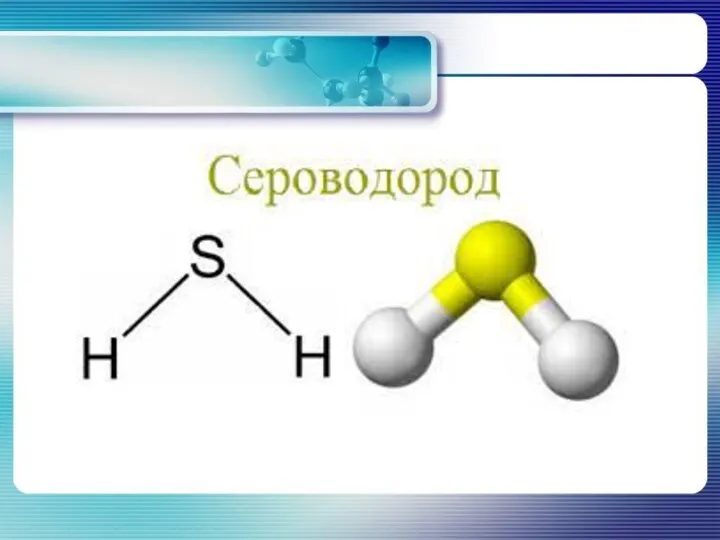
- 4. Сероводород Физические свойства Газ бесцветный запах тухлых яиц ядовит хорошо растворим в воде (сероводородная кислота)
- 5. Получение сероводорода 3. Na2S + 2H2O = 2NaOH + H2S Применение: H2S – для лечения кожных
- 6. Химические свойства
- 7. Химические свойства Взаимодействует с галогенами
- 8. H2S бескислородная, двухосновная, слабая. Имеет запах гниющего белка, тяжелее воды. Сероводородная кислота
- 9. Сероводородная кислота Химические свойства: Проявляет типичные кислотные свойства: взаимодействует с металлами: Zn + H2S = ZnS
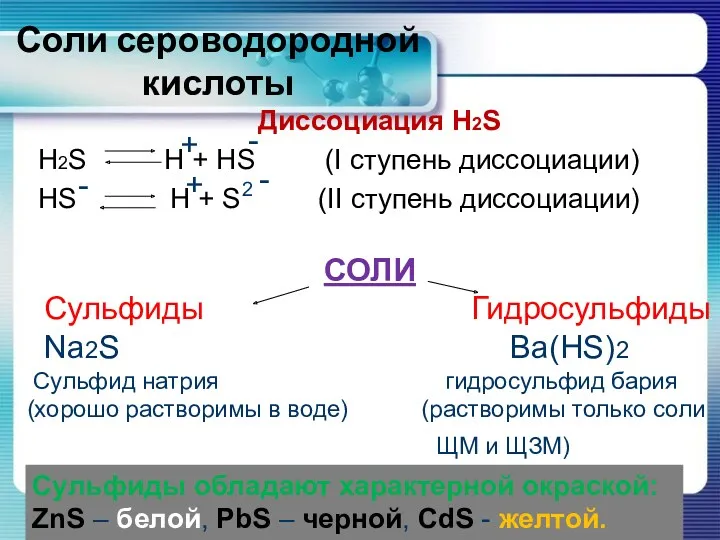
- 10. Соли сероводородной кислоты Диссоциация H2S H2S H + HS (I ступень диссоциации) HS H + S
- 11. Диоксид серы газ Бесцветный запах резкий, удушающий tкип = -10С S O2 SO2 Хорошо растворим в
- 12. Оксид серы(IV), сернистая кислота и ее соли
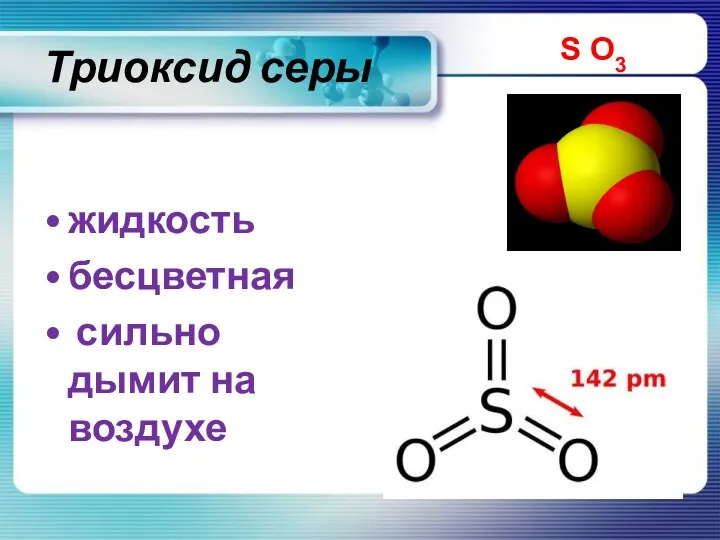
- 14. Триоксид серы жидкость бесцветная сильно дымит на воздухе S O3
- 15. Получение оксида серы (VI) 2SO2 + O2 2SO3 Оксид SO3 хорошо растворим в воде, образует серную
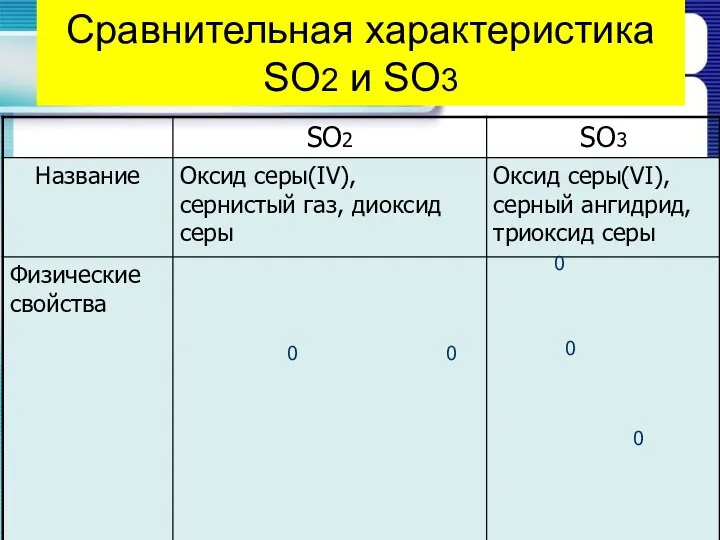
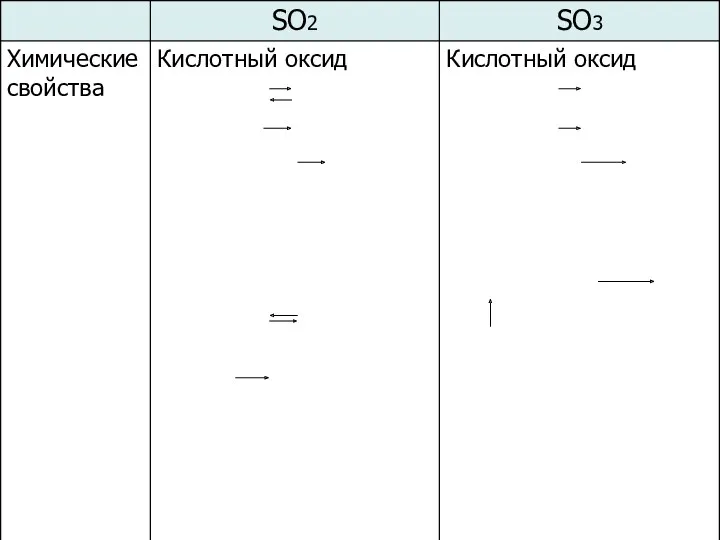
- 16. Сравнительная характеристика SO2 и SO3 0 0 0 0 0
- 18. Закрепление
- 19. Закрепление
- 20. Серная кислота H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 21. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 22. Серная кислота является сильным электролитом, но как двухосновная кислота диссоциирует в 2 ступени: H2SO4 = Н+
- 23. Химические свойства
- 24. Химические свойства разбавленной H2SO4
- 25. Разбавленная серная кислота реагирует с металлами стоящими ряду напряжения металлов до водорода (Н) в выделением последнего.
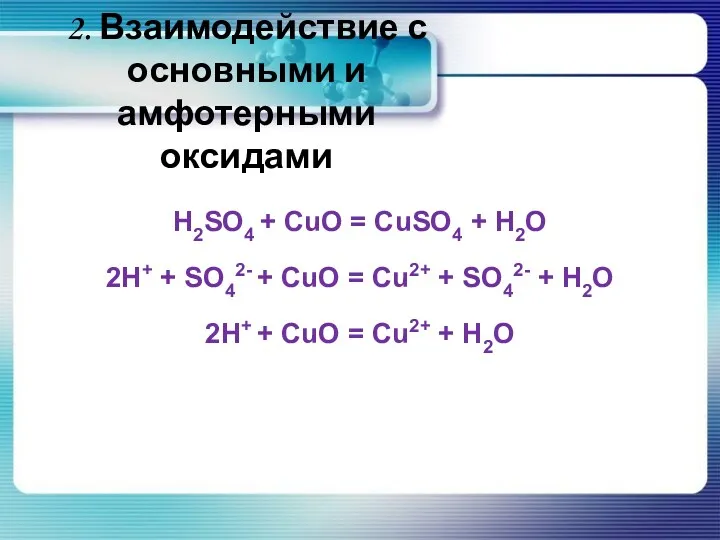
- 26. 2. Взаимодействие с основными и амфотерными оксидами H2SO4 + CuO = CuSO4 + H2O 2H+ +
- 27. 3. Взаимодействие с основаниями: а) щелочами H2SO4 + 2NaOH = Na2SO4 + 2H2O 2H+ + SO42-
- 28. H2SO4 + BaCl2 = BaSO4↓+ 2HCl 2H+ + SO42- + Ba2+ + 2Cl- = BaSO4↓+ 2H+
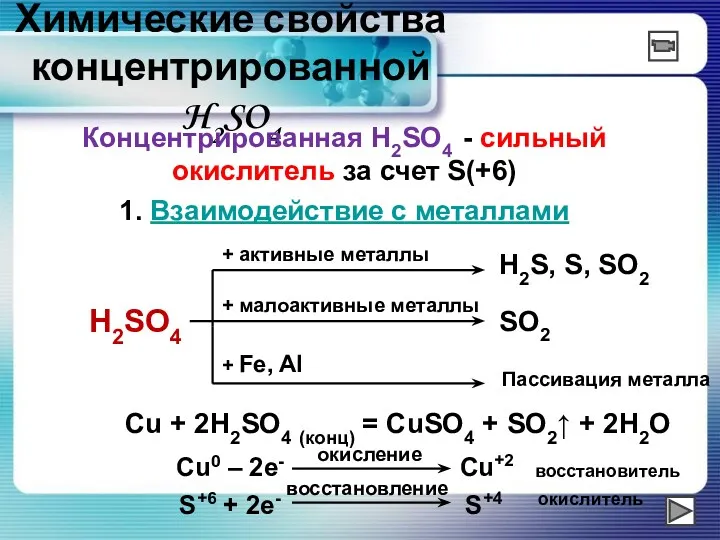
- 29. Химические свойства концентрированной H2SO4 Концентрированная H2SO4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами
- 30. 2. Взаимодействие с неметаллами 2H2SO4 + C = CO2 + 2SO2 + 2H2O 3. Взаимодействие с
- 31. Серная кислота-окислитель Концентрированная серная кислота, особенно горячая ,- энергичный окислитель 8HJ + H2 SO4 = 4
- 32. Соли серной кислоты
- 33. Применение H2SO4 HNO3 Производство кислот Взрывчатые вещества Электролитическая медь Минеральные удобрения Лекарства Производство солей Искусственный шелк
- 34. Производство серной кислоты l стадия производства – обжиг: S + O2 =SO2 +297 кДж 4FeS2 +
- 35. Кислотные дожди
- 36. Кислотные дожди Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции и Рима, простояв
- 37. Применение знаний: Осуществить цепочку превращений: S S S S S 0 -2 -2 +4 +6
- 38. Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А)
- 39. Тест (ответы) 1 – Г 2 – Б 3 – Г 4 – А
- 40. Домашнее задание Параграф 23, №4 Выполните цепочку превращений из презентации
- 42. Скачать презентацию






























 Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Азот и фосфор
Азот и фосфор Застосування неметалів
Застосування неметалів Ионная связь
Ионная связь Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Уральские горы. Самоцветы
Уральские горы. Самоцветы Гидролиз органических и неорганических веществ, солей
Гидролиз органических и неорганических веществ, солей Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Источники низших олефинов
Источники низших олефинов Уход за волосами
Уход за волосами Способы получения металлов
Способы получения металлов Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7)
Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7) Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Хімічні властивості оксидів
Хімічні властивості оксидів Тест: полимеры
Тест: полимеры Решение задач. Органическая химия
Решение задач. Органическая химия Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Этот удивительный песок
Этот удивительный песок Природный газ и нефть
Природный газ и нефть Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов