Содержание
- 2. Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочкой.
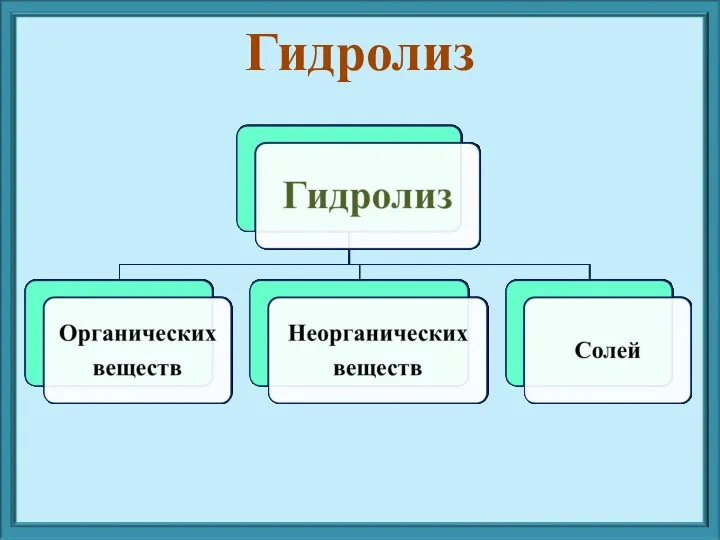
- 3. Гидролиз
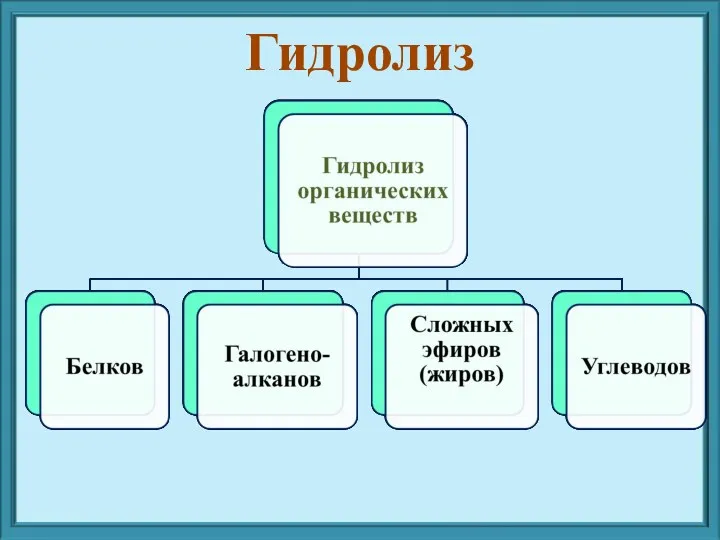
- 4. Гидролиз
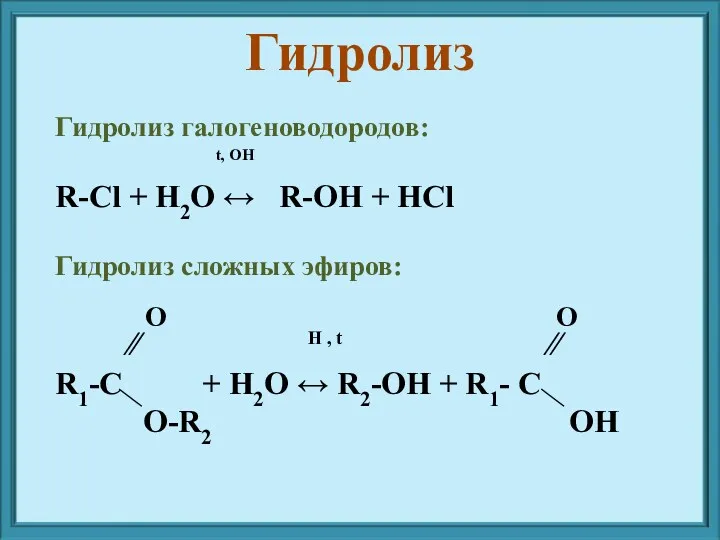
- 5. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
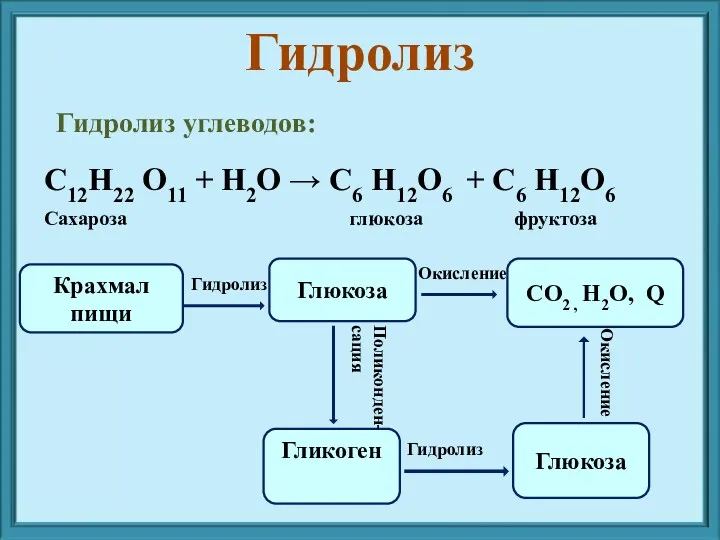
- 6. Гидролиз углеводов: Крахмал пищи Глюкоза CO2 , H2O, Q Гликоген Глюкоза Гидролиз Окисление Поликонден- сация Гидролиз
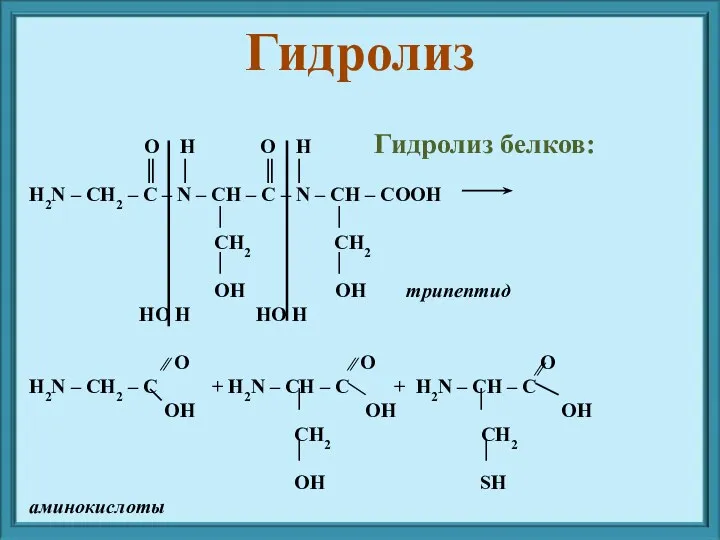
- 7. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
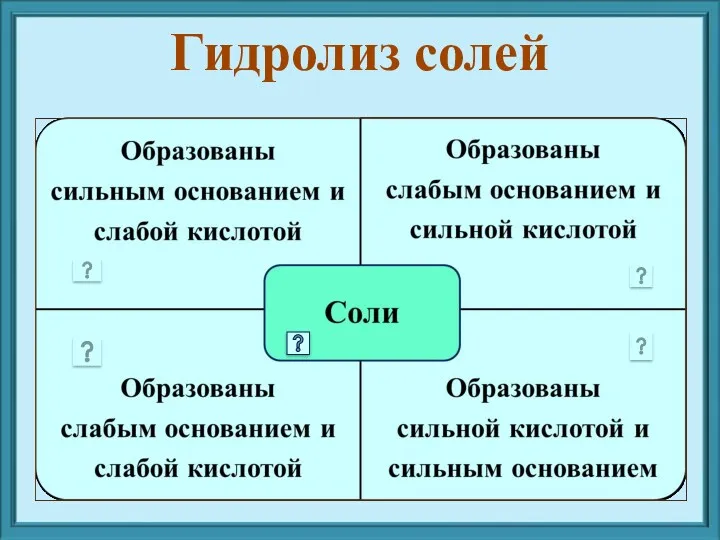
- 8. Гидролиз солей Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды.
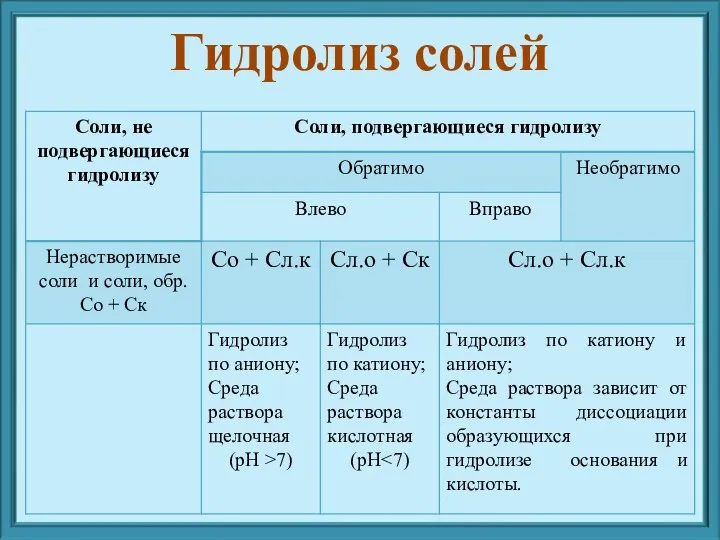
- 9. Гидролиз солей
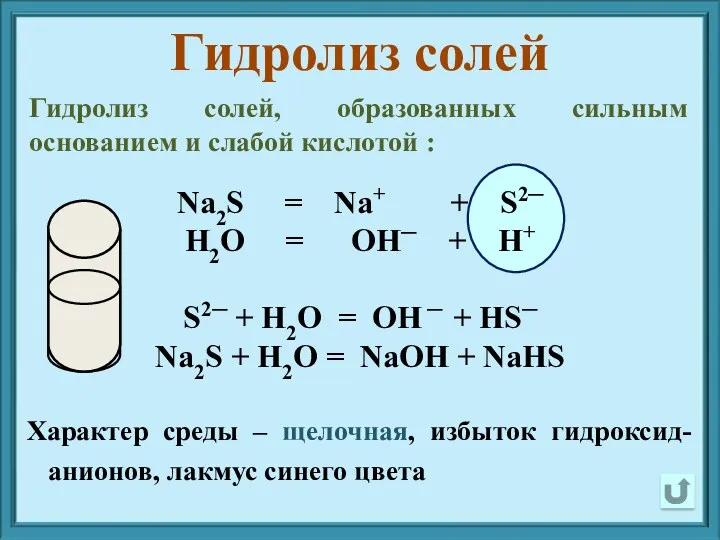
- 10. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
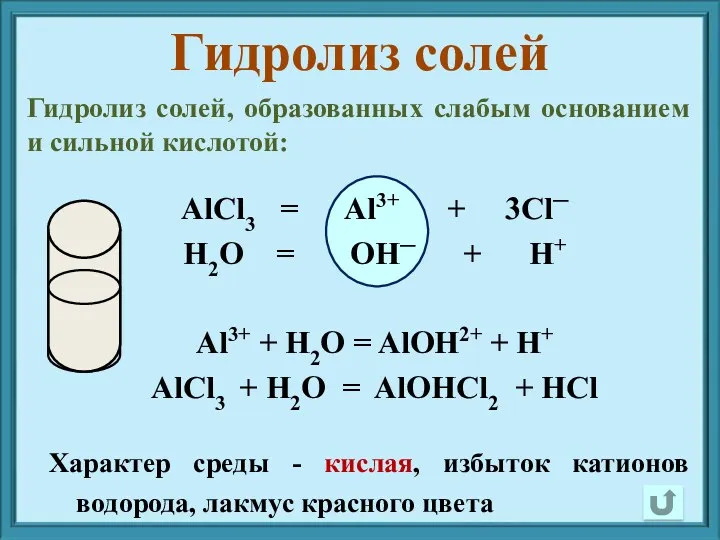
- 11. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
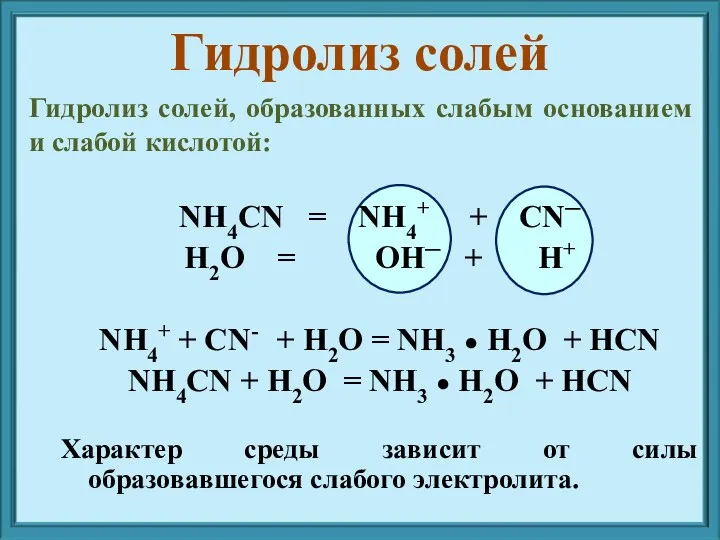
- 12. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
- 13. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
- 14. Гидролиз солей, образованных сильным основанием и сильной кислотой: Гидролиз солей Слабых ионов нет, гидролиз не идет,
- 15. Гидролиз солей
- 16. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
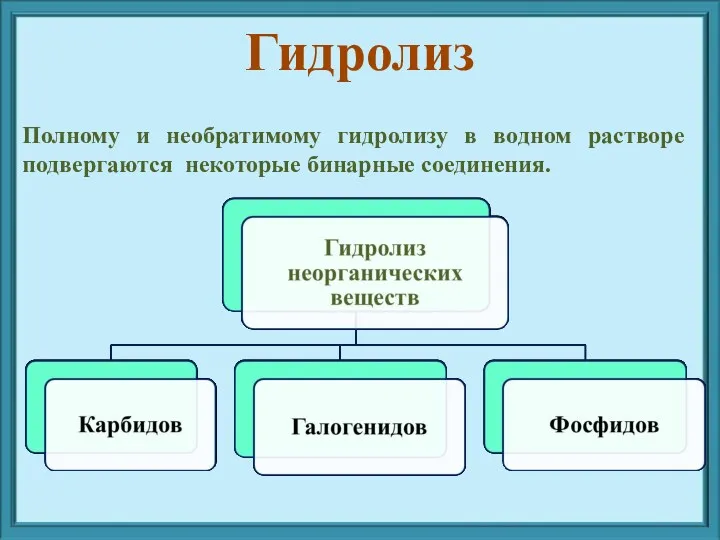
- 17. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения. Гидролиз
- 18. Гидролиз Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 +
- 19. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремния (+4) Гидролиз фосфидов: Са3P2 +
- 21. Скачать презентацию







 Химическое сопротивление меди и ее сплавов
Химическое сопротивление меди и ее сплавов Гетероциклические соединения
Гетероциклические соединения Круговорот углерода в природе
Круговорот углерода в природе Гідроліз солей
Гідроліз солей Элементы теории горения
Элементы теории горения Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду Электролитическая диссоциация. Сущность электролитической диссоциации
Электролитическая диссоциация. Сущность электролитической диссоциации Хімія в побуті
Хімія в побуті c0198e3edf1db804a5527004a7864ed1
c0198e3edf1db804a5527004a7864ed1 Силикатная промышленность
Силикатная промышленность Реакции деструкции макромолекул
Реакции деструкции макромолекул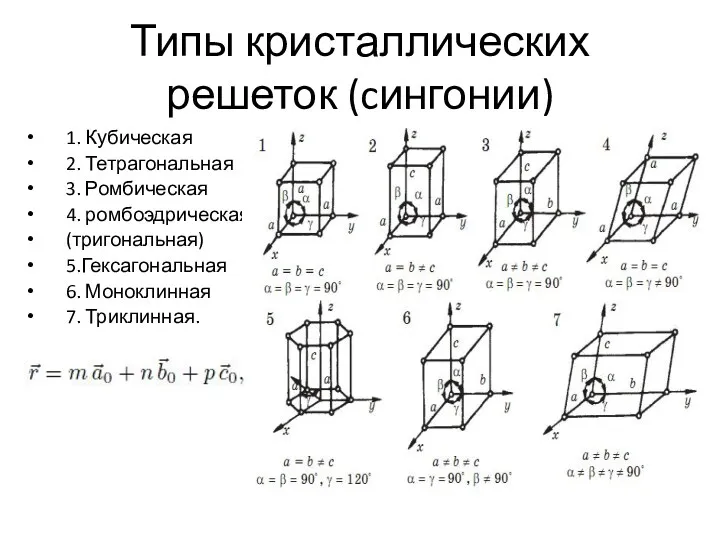 Типы кристаллических решеток, cингонии. (Лекция 2)
Типы кристаллических решеток, cингонии. (Лекция 2) Р-элементы IV группы
Р-элементы IV группы Камни и Стрелец
Камни и Стрелец Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Аммиак
Аммиак Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов
Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов Адсорбция. Раздел III
Адсорбция. Раздел III Механизм реакции в органической химии
Механизм реакции в органической химии Кислотно-основные равновесия. Введение в титриметрию
Кислотно-основные равновесия. Введение в титриметрию Реакции ионного обмена
Реакции ионного обмена Физические свойства минералов
Физические свойства минералов Азот. Физические свойства
Азот. Физические свойства Кислородные соединения азота
Кислородные соединения азота Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Химия. 9 класс
Химия. 9 класс