Содержание
- 2. План лекции: 1. Протолитические равновесия в титриметрии 2. Буферные растворы 3. Вычисления рН растворов протолитов 4.
- 3. Литература каф. аналитической химии РХТУ им. Д.И. Менделеева
- 4. Теории кислотно-основного взаимодействия Теория Аррениуса: кислота – частица, которая диссоциирует с отщеплением протона, основание - с
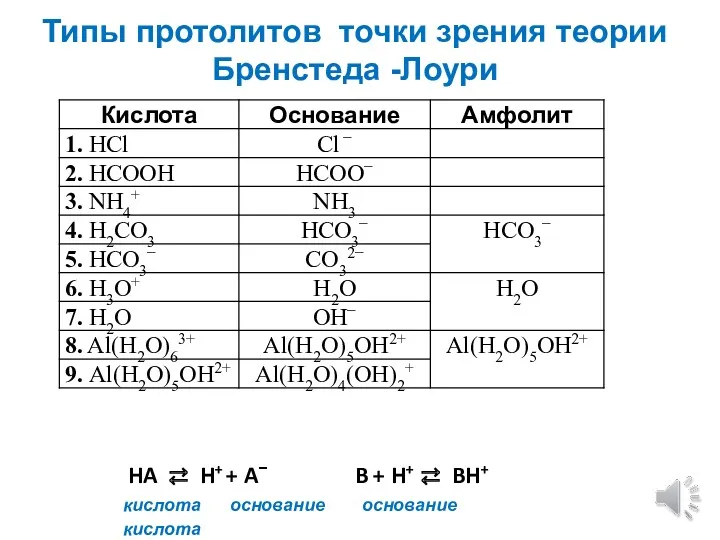
- 5. Типы протолитов точки зрения теории Бренстеда -Лоури HA ⇄ H+ + A− B + H+ ⇄
- 6. Автопротолиз растворителя (самоионизация)
- 7. Состояние протолитов в водных растворах Расчет рН в растворах сильных электролитов: 1. Сильные протолиты
- 8. Рассчитайте концентрацию ионов водорода [H+] и рН водных 0,01 M растворов HCl и NaOH Кислота: [H+]
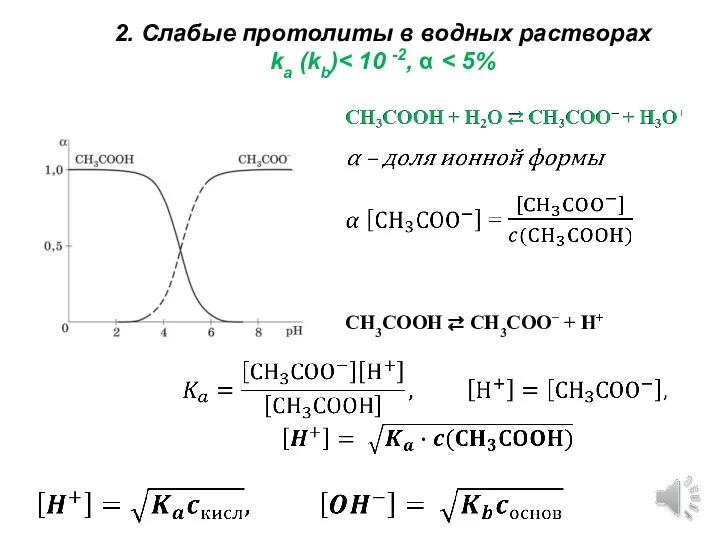
- 9. 2. Слабые протолиты в водных растворах ka (kb) ; , СН3СOOH ⇄ CH3COO− + H+
- 10. 3. Состояние многоосновных кислот и оснований в водных растворах Ступенчатая диссоциация фосфорной кислоты: В зависимости от
- 11. Рассчитайте рН 0,01 М раствора муравьиной кислоты НСООН, константа кислотности муравьиной кислоты (Кa) равна 2∙10 −4.
- 13. Скачать презентацию





![Рассчитайте концентрацию ионов водорода [H+] и рН водных 0,01 M](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/301417/slide-7.jpg)


 Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Алюміній
Алюміній Калийные Удобрения
Калийные Удобрения Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Решение задач по теме: «Электролиз»
Решение задач по теме: «Электролиз» Методы в химии
Методы в химии Химический элемент сера
Химический элемент сера Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Электролиз
Электролиз Атом - сложная частица
Атом - сложная частица Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Химическая термодинамика
Химическая термодинамика Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число
Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число Химический состав прямогонных бензинов
Химический состав прямогонных бензинов Альдегиды и кетоны. Определение
Альдегиды и кетоны. Определение Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9 Аминокислоты. Белки
Аминокислоты. Белки Йодометрия
Йодометрия Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8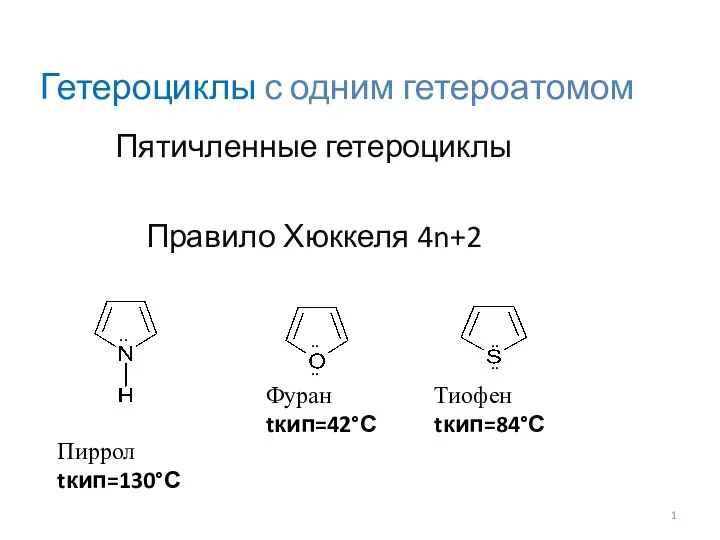 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Золото и серебро
Золото и серебро Неорганические соединения галогенов
Неорганические соединения галогенов Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства