Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства презентация
Содержание
- 2. 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус.
- 3. МЕДЬ Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают:
- 4. ЖЕЛЕЗО Пахать и строить - все он может, если ему уголек в том поможет…
- 5. - - 1. нейтральные атомы. 2. положительно заряженные ионы. ē – свободно перемещаются по кристаллической решетке.
- 6. Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
- 7. Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и
- 8. Положение элемента в ПС отражает строение его атомов
- 9. Модель атома натрия
- 10. Электронное строение атома натрия
- 11. Задание 2. Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно по примеру с
- 12. Вывод: 1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже 4-6. 2. Металлы –
- 13. Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно связывают множество ядер;
- 14. Кристаллические решетки металлов тетрагональная Тетрагональная объёмноцентрическая ромбоэдрическая гексагональная кубическая Кубическая объёмноцентрическая Кубическая гранецентрированная
- 15. Видеоинформация о кристаллах металлов
- 16. Свойства металлов определяются строением их атомов.
- 17. Проверьте усвоение знаний на уроке тестированием
- 18. Задания теста 2 и 3
- 19. Задания теста 4 и 5
- 21. Скачать презентацию


















 Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Определение окисляемости воды
Определение окисляемости воды Основные задачи и понятия химической метрологии
Основные задачи и понятия химической метрологии Удивительные свойства воды
Удивительные свойства воды Классификация химических элементов
Классификация химических элементов Классификация и свойства кислот
Классификация и свойства кислот Контроль качества пищевых товаров
Контроль качества пищевых товаров Кислород и оксиген
Кислород и оксиген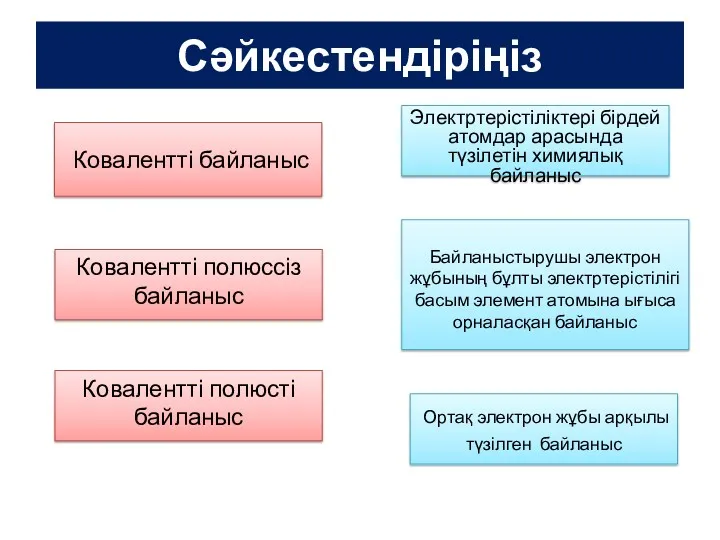 Иондық байланыс
Иондық байланыс Газовые смеси
Газовые смеси Алюминий и его соединения
Алюминий и его соединения Кислород. Химия – 8 класс
Кислород. Химия – 8 класс Углекислый газ СО2
Углекислый газ СО2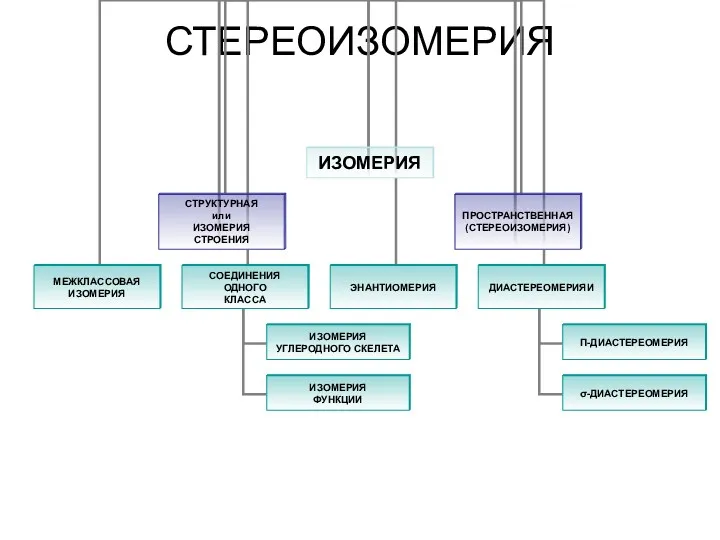 Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета 20230212_urok_ionnye_uravneniya
20230212_urok_ionnye_uravneniya Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Растворы. Свойства растворов. (Тема 3)
Растворы. Свойства растворов. (Тема 3) Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Качественный анализ (часть 1)
Качественный анализ (часть 1) Нанопористые материалы
Нанопористые материалы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Щелочные металлы. Положение в ПСХЭ
Щелочные металлы. Положение в ПСХЭ Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Понятие биогенности химических элементов
Понятие биогенности химических элементов