Содержание
- 2. Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка.
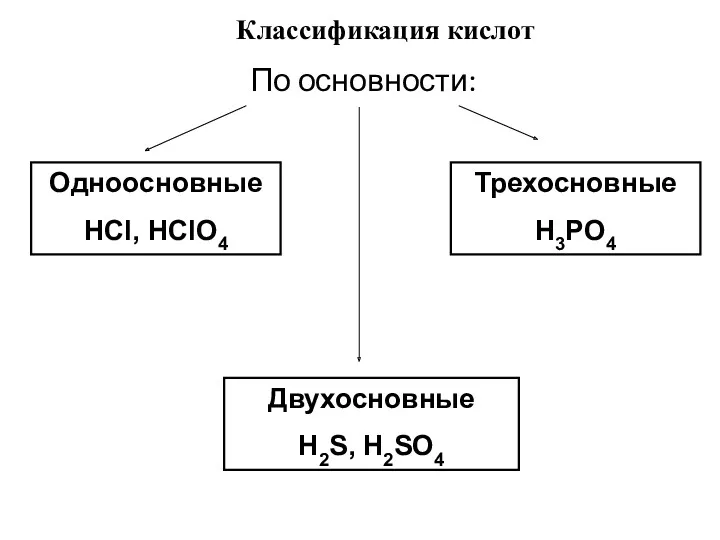
- 3. По основности: Одноосновные HCl, HClO4 Двухосновные H2S, H2SO4 Трехосновные H3PO4 Классификация кислот
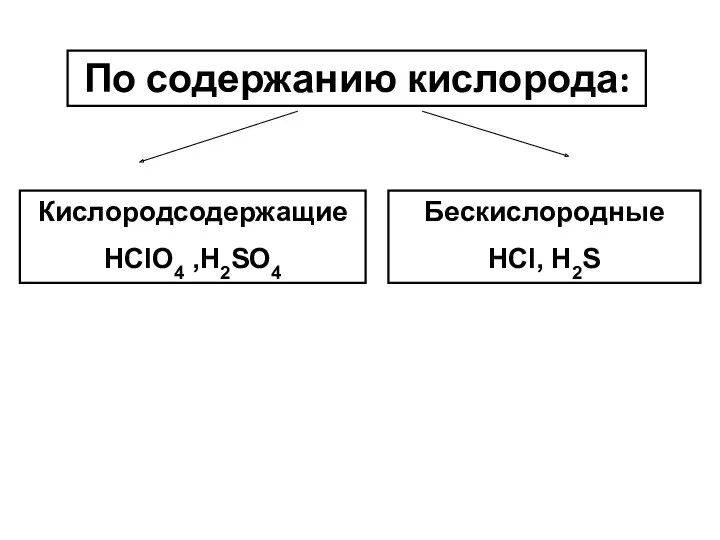
- 4. По содержанию кислорода: Кислородсодержащие HClO4 ,H2SO4 Бескислородные HCl, H2S
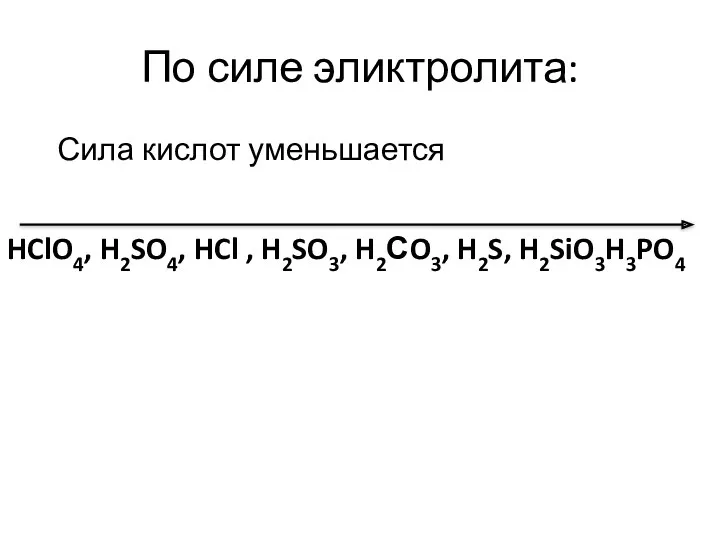
- 5. По силе эликтролита: Сила кислот уменьшается HClO4, H2SO4, HCl , H2SO3, H2СO3, H2S, H2SiO3H3PO4
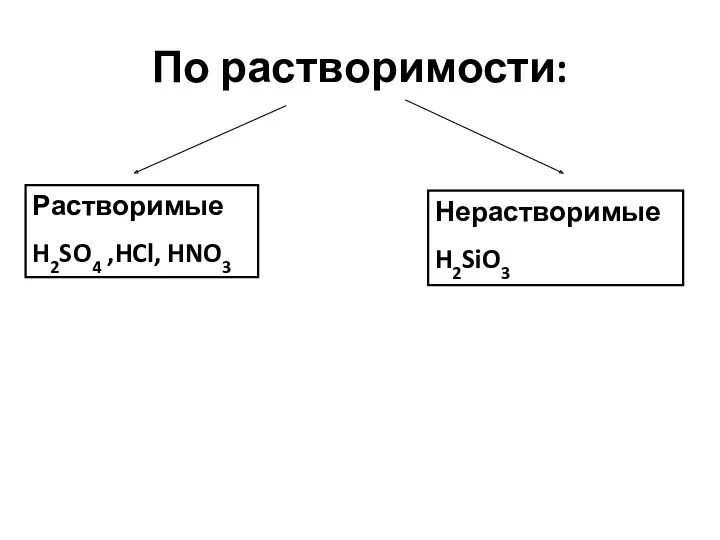
- 6. По растворимости: Растворимые H2SO4 ,HCl, HNO3 Нерастворимые H2SiO3
- 7. Правила техники безопасности при работе с кислотами 1. При разбавлении кислот водой следует кислоту тонкой струйкой
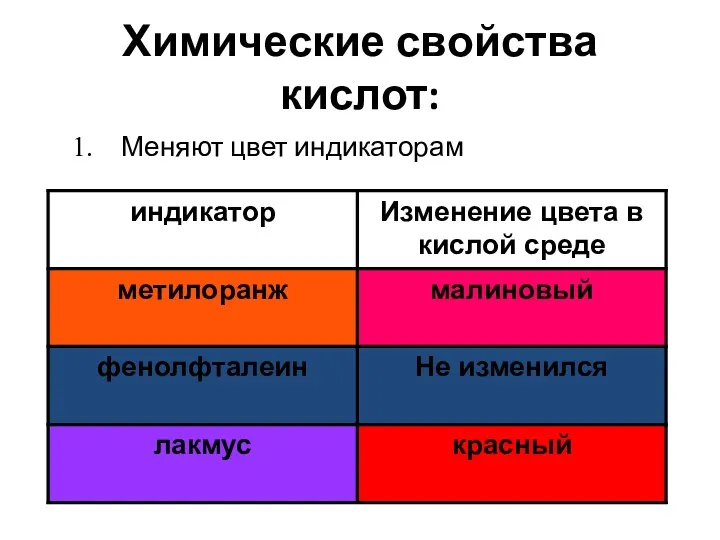
- 8. Химические свойства кислот: Меняют цвет индикаторам
- 9. 2. Кислота + Металл→ соль + Н2 Три условия: кислота растворимая (кроме HNO3) Ме стоит в
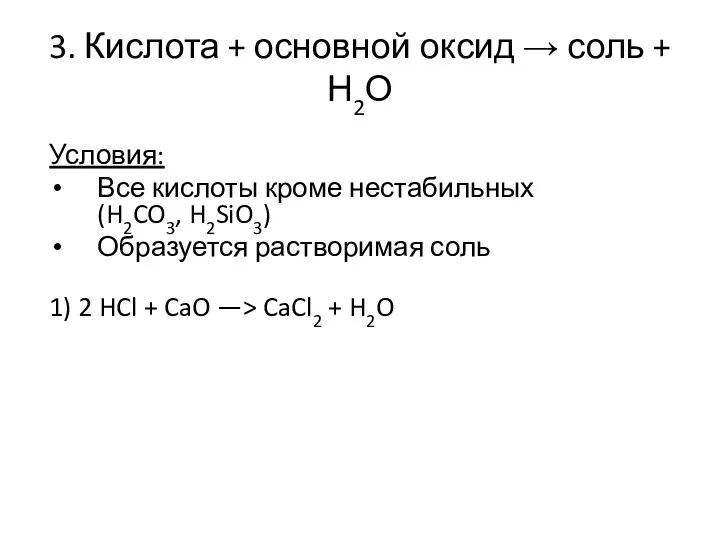
- 10. 3. Кислота + основной оксид → соль + Н2О Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3)
- 11. 4. Кислота + амфотерный оксид → соль + Н2О Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3)
- 12. 5. Кислота + основание → соль + Н2О (реакция нейтрализации) 1) H2SO4 + 2 KOH —>
- 13. 6. Кислота + соль → соль + кислота Должно выполняться одно из двух условий: Один из
- 14. 7. При нагревании некоторые кислоты разлагаются. Как правило, образуются кислотный оксид и вода. Т 1) H2SiO3
- 15. Способы получения кислот: 1. Кислотный оксид + Н2О → кислота SO3 + H2O → H2SO4 2.
- 17. Скачать презентацию








 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука