Содержание
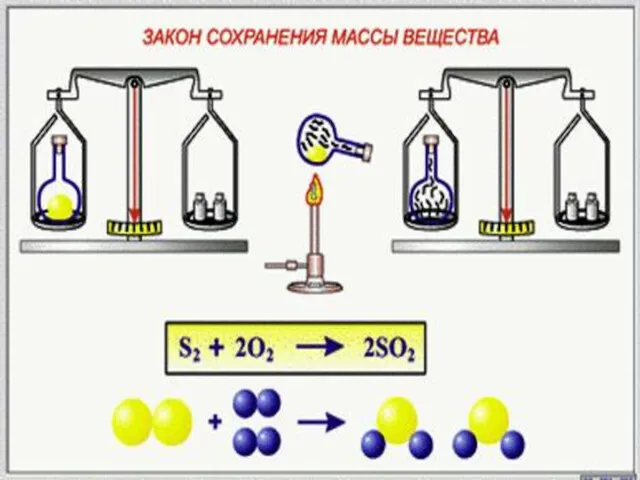
- 2. М.В.Ломоносов в 1748 г. впервые сформулировал, а в 1756 г. экспериментально доказал закон сохранения массы веществ
- 3. Формулировка закона Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
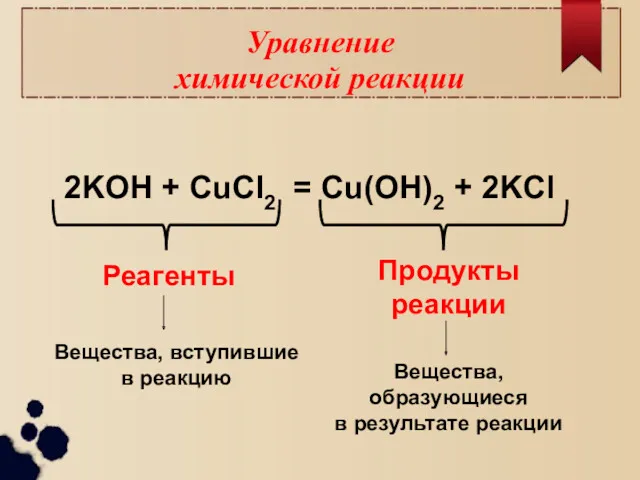
- 5. Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и математических знаков.
- 6. Уравнение химической реакции 2KOH + CuCl2 = Cu(OH)2 + 2KCl Реагенты Продукты реакции Вещества, вступившие в
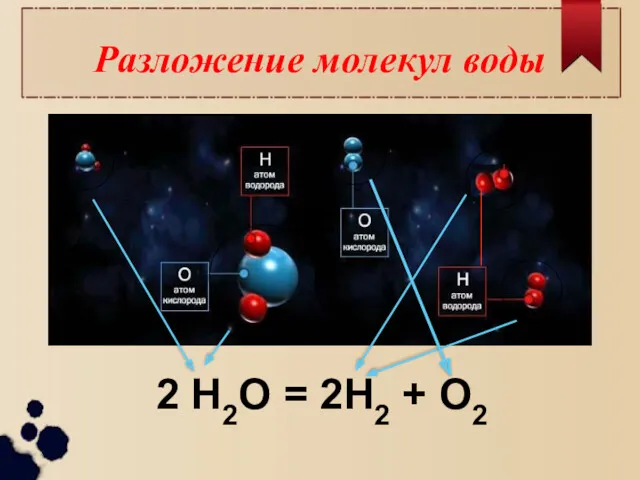
- 7. Разложение молекул воды 2 Н2О = 2Н2 + О2
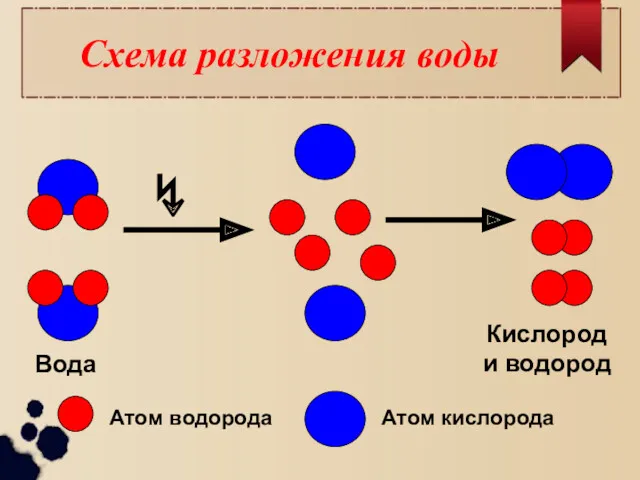
- 8. Схема разложения воды Атом водорода Атом кислорода ↯ Вода Кислород и водород
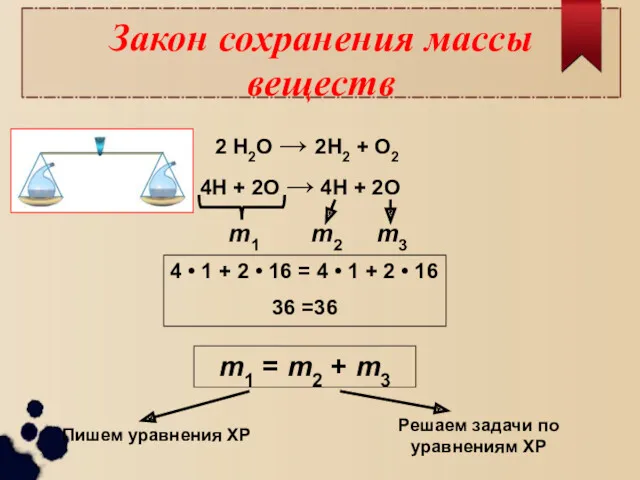
- 9. Закон сохранения массы веществ 2 Н2О → 2Н2 + О2 4Н + 2О → 4Н +
- 10. Алгоритм составления уравнений химических реакций В левой части записываются формулы веществ, которые вступают в реакцию: KOH
- 11. Основные правила расстановки коэффициентов Расстановку коэффициентов начинают с элемента, чьих атомов в реакции участвует больше. Количество
- 12. Закрепление 1. Cu + O2 → CuO 2. HCl → H2 +Cl2 3. Ag2O + C
- 14. Скачать презентацию






 Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Угольная кислота и ее соли. 9 класс
Угольная кислота и ее соли. 9 класс Хроматографические методы анализа
Хроматографические методы анализа Нанохимия
Нанохимия Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Группа галогенов в периодической системе
Группа галогенов в периодической системе Химические свойства кислот
Химические свойства кислот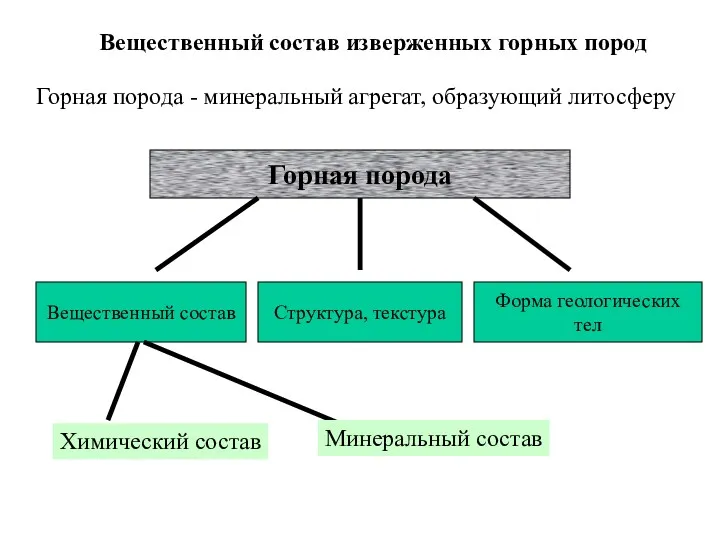 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Химические свойства металлов
Химические свойства металлов Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Периодический закон и строение атома
Периодический закон и строение атома Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Метаморфогенные месторождения
Метаморфогенные месторождения Кислород. Открытие кислорода
Кислород. Открытие кислорода Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Склад і основні фізико-хімічні властивості молочного білку
Склад і основні фізико-хімічні властивості молочного білку Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества