Содержание
- 2. Историческая справка. По мере развития химии как отрасли науки и открытия многих новых элементов ряд ученых
- 3. «Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в
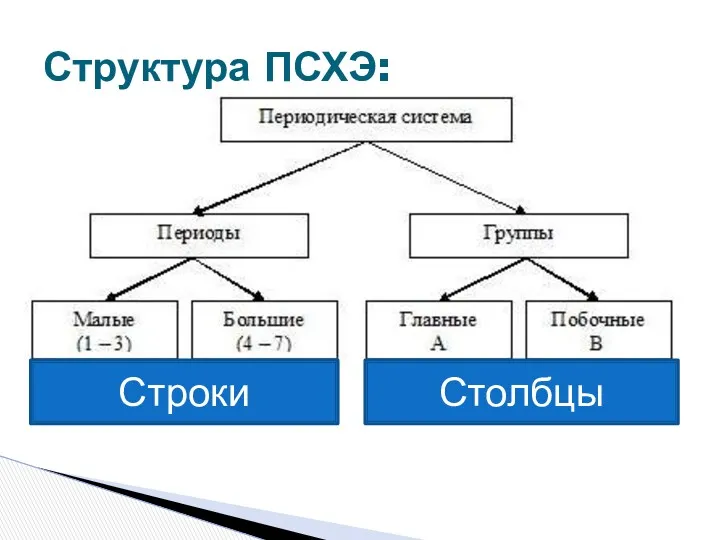
- 4. Структура ПСХЭ: Столбцы Строки
- 6. Заполните схему:
- 7. Заполнить схему:
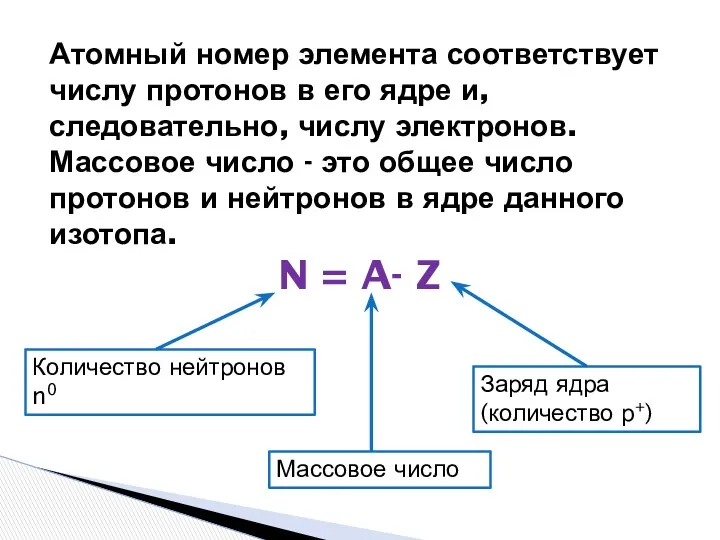
- 8. Атомный номер элемента соответствует числу протонов в его ядре и, следовательно, числу электронов. Массовое число -
- 9. Характеристика элемента включает: 1- Положение в п/c: Порядковый номер, массовое число Номер периода Номер группы Главная
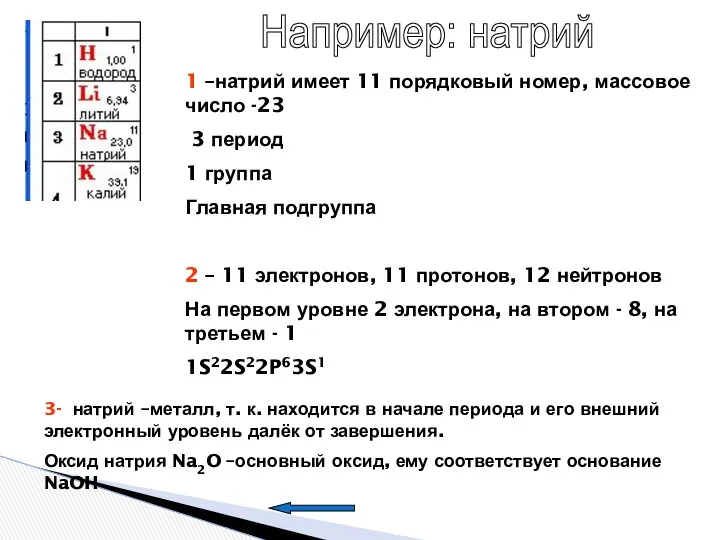
- 10. Например: натрий 1 –натрий имеет 11 порядковый номер, массовое число -23 3 период 1 группа Главная
- 12. Скачать презентацию






 Месторождения берилла и топаза
Месторождения берилла и топаза Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Соединения железа
Соединения железа Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Методика преподавания химии
Методика преподавания химии Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электронные конфигурации атомов
Электронные конфигурации атомов Метод молекулярных орбиталей
Метод молекулярных орбиталей Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы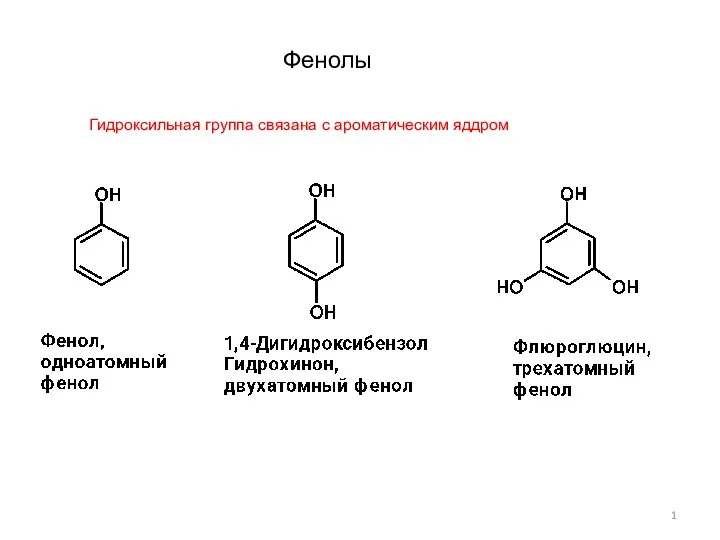 Фенолы-1
Фенолы-1 Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Сложные эфиры
Сложные эфиры Основні класи неорганічних сполук
Основні класи неорганічних сполук Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Производство полимеров
Производство полимеров Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Гетероциклические соединения
Гетероциклические соединения Свойства воды. Оценка качества
Свойства воды. Оценка качества Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою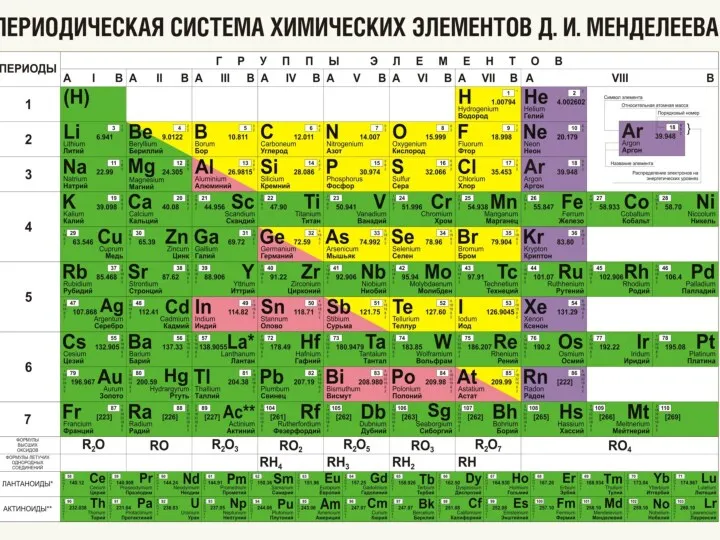 ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Solutions and solubilities
Solutions and solubilities Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ