Содержание
- 2. Процесс распада электролита на ионы называется электролитической диссоциацией.
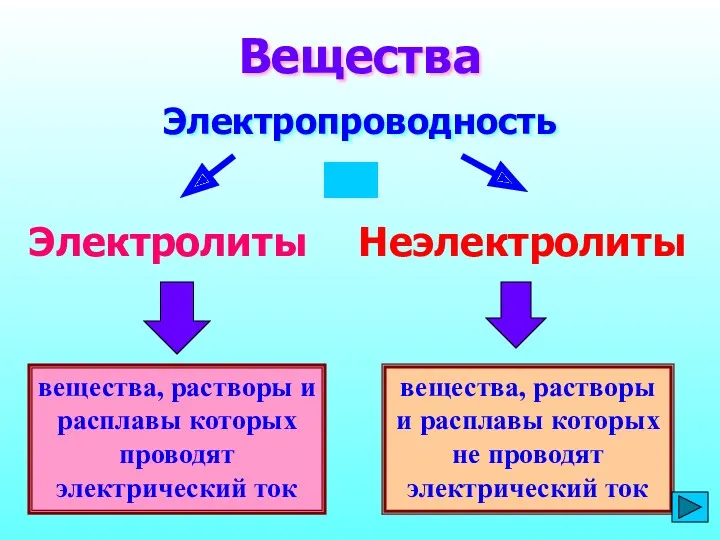
- 3. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
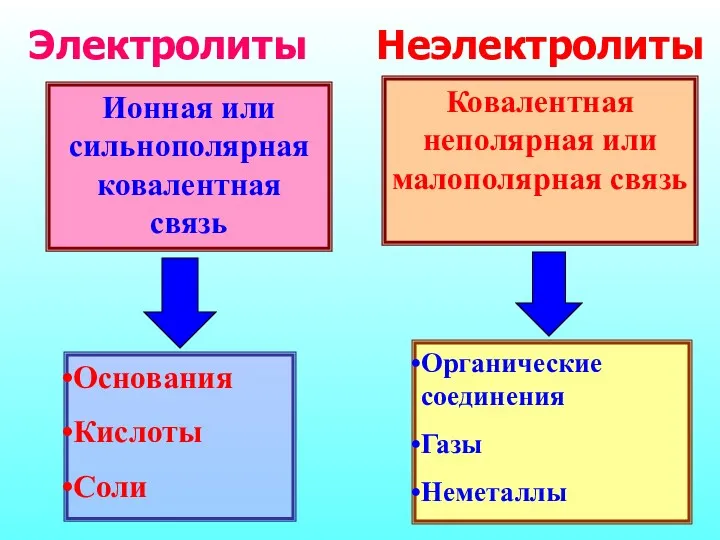
- 5. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Ковалентная неполярная или малополярная связь Органические соединения Газы
- 6. Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить
- 7. 1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация.
- 10. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
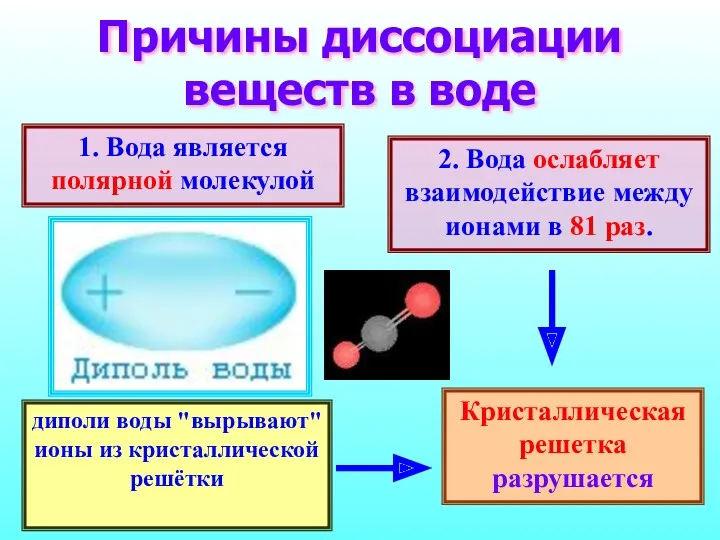
- 11. Причины диссоциации веществ в воде 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами
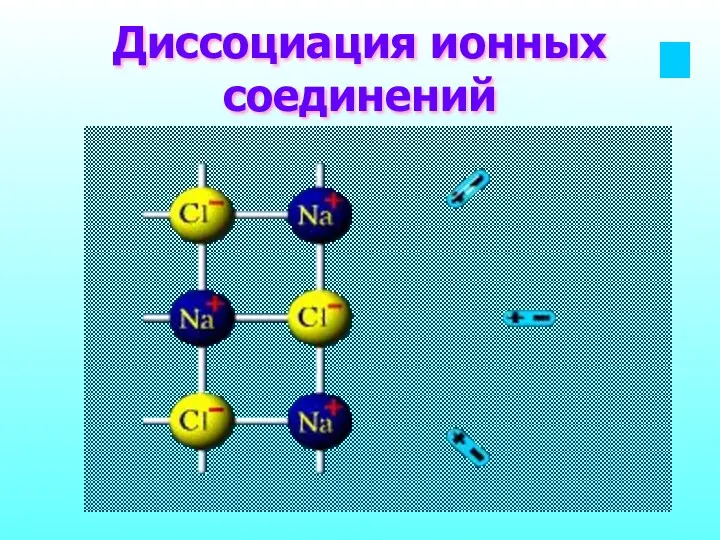
- 12. Диссоциация ионных соединений
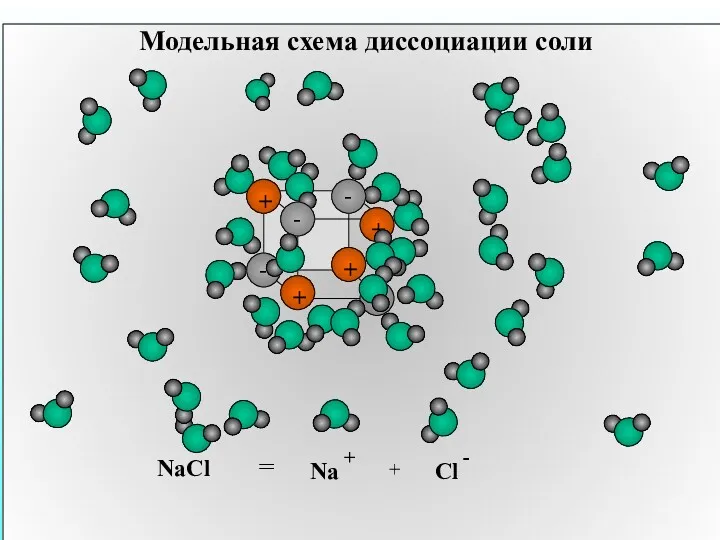
- 13. Модельная схема диссоциации соли NaCl = + Na +
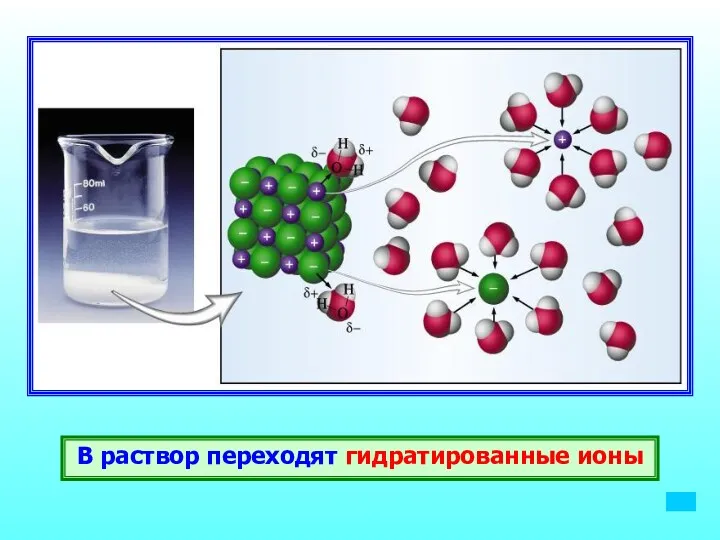
- 14. В раствор переходят гидратированные ионы
- 15. Диссоциация соединений с КП связью
- 16. Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения
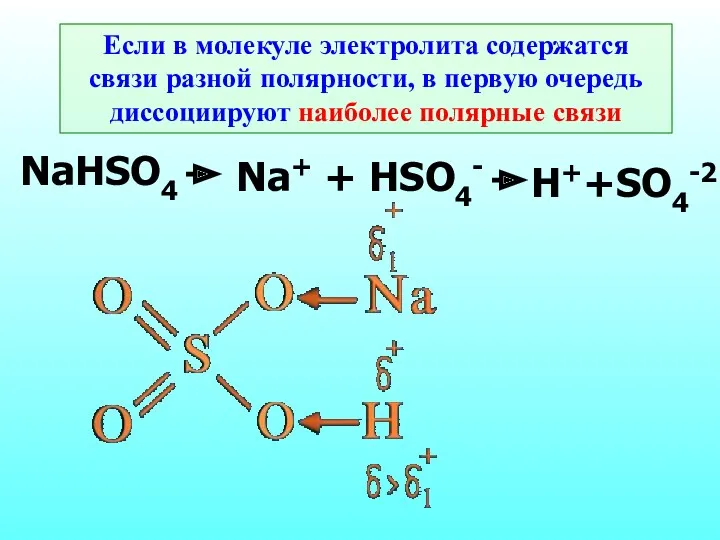
- 17. Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи NaHSO4
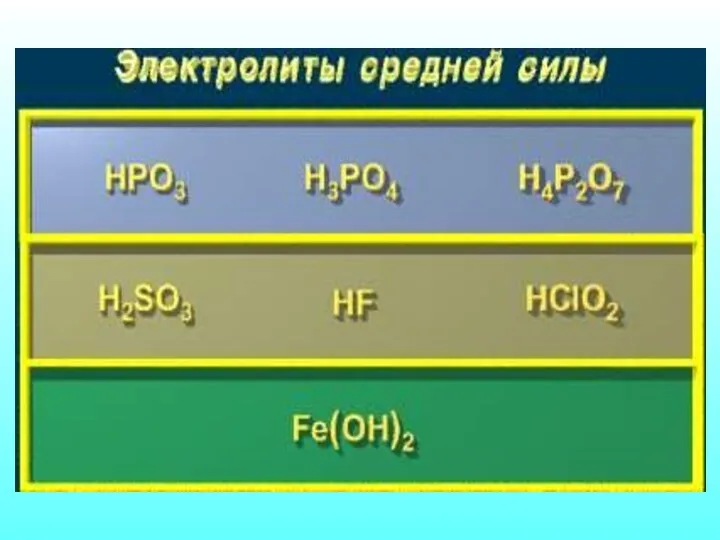
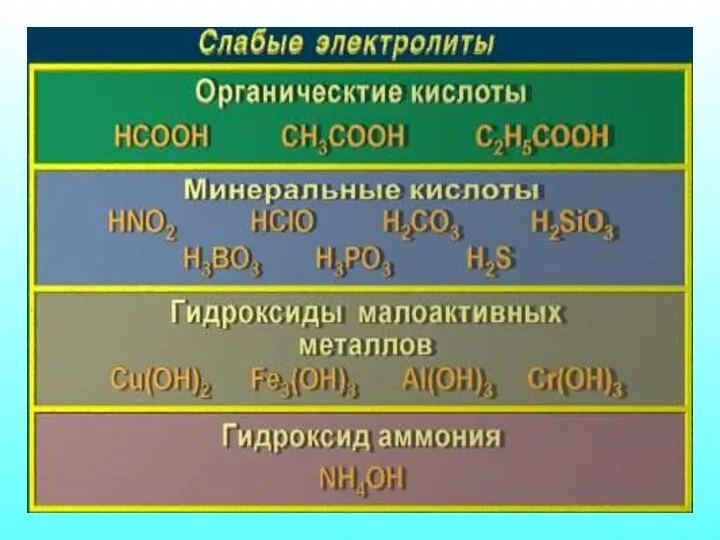
- 18. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
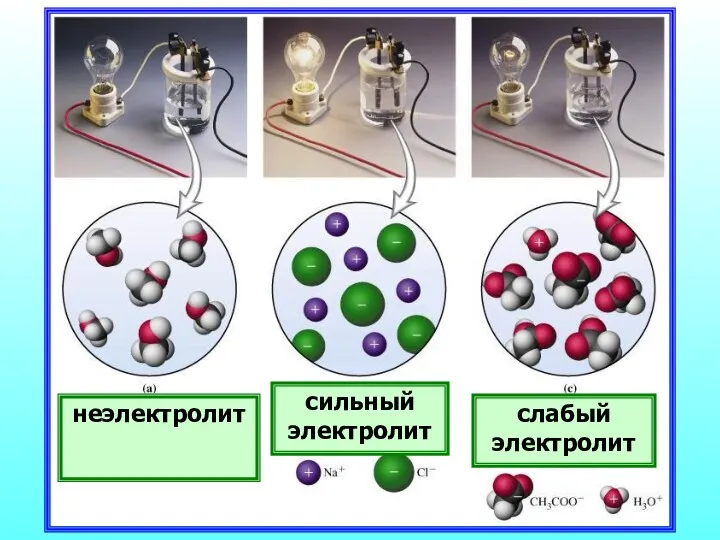
- 20. неэлектролит сильный электролит слабый электролит
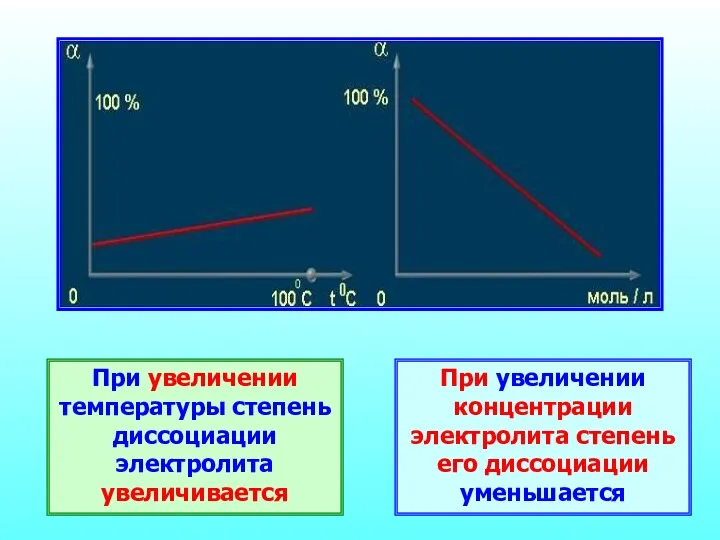
- 24. При увеличении температуры степень диссоциации электролита увеличивается При увеличении концентрации электролита степень его диссоциации уменьшается
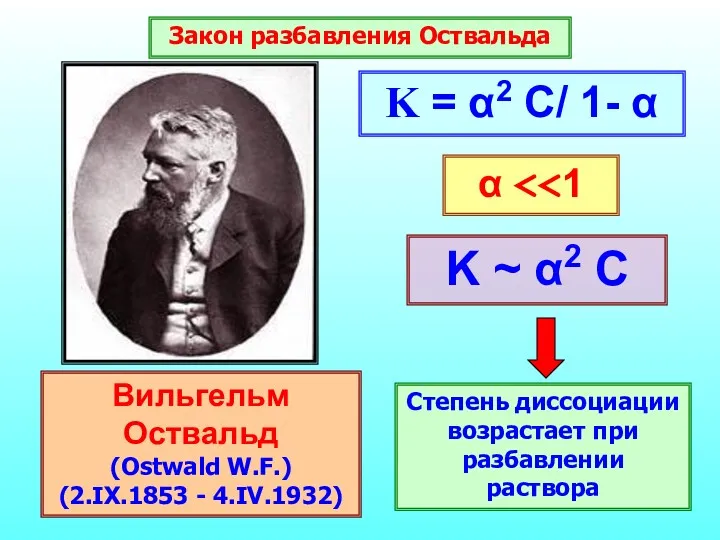
- 25. Константа диссоциации Характеризует способность слабого электролита распадаться на ионы
- 26. Вильгельм Оствальд (Ostwald W.F.) (2.IX.1853 - 4.IV.1932) Закон разбавления Оствальда K ~ α2 C Степень диссоциации
- 27. Задание для 1 группы: Впишите недостающие слова: Все вещества по их способности проводить электрический ток в
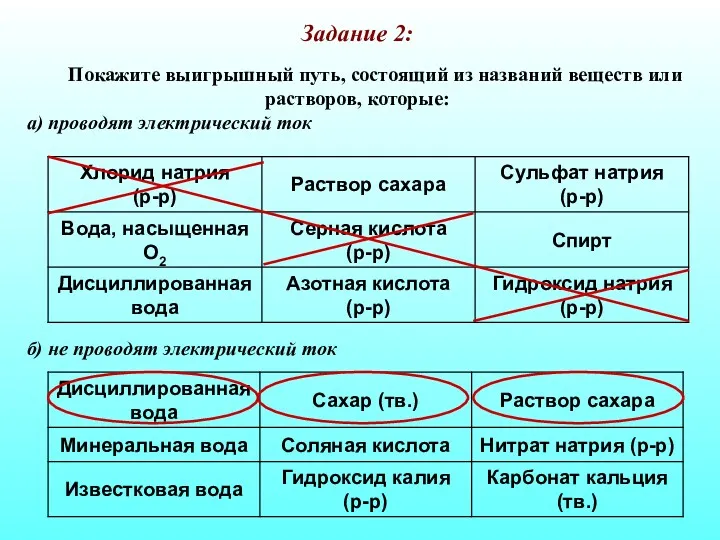
- 28. Задание 2: Покажите выигрышный путь, состоящий из названий веществ или растворов, которые: а) проводят электрический ток
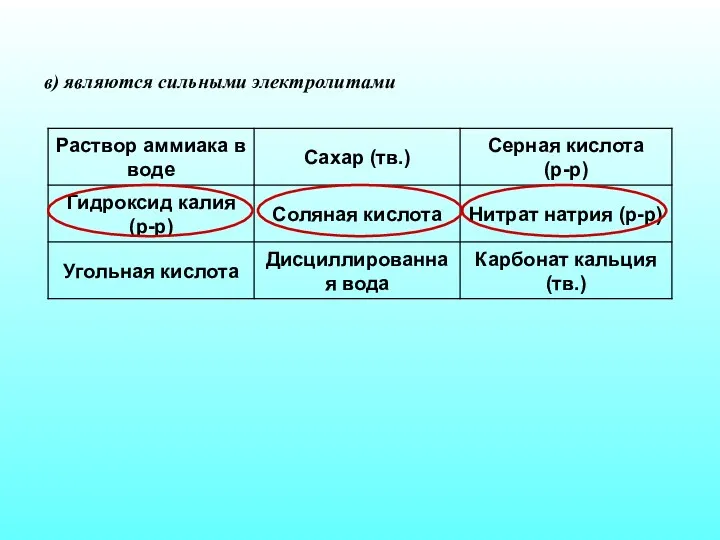
- 29. в) являются сильными электролитами
- 31. Скачать презентацию












 Комплексные соединения
Комплексные соединения Особенности полимерного состояния вещества
Особенности полимерного состояния вещества Бинарные соединения АхБу. Номенклатура бинарных соединений
Бинарные соединения АхБу. Номенклатура бинарных соединений Каменный уголь. Фенол
Каменный уголь. Фенол Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Аналитическая химия
Аналитическая химия Алкадиены
Алкадиены Химия 20 века
Химия 20 века Коррозия металлов
Коррозия металлов Акриловые волокна
Акриловые волокна Синтетичні волокна
Синтетичні волокна ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Кислород. Общая характеристика, получение и свойства
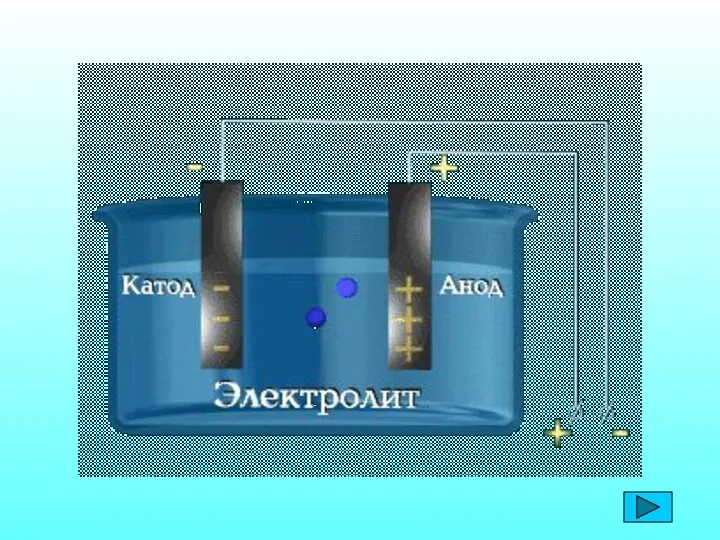
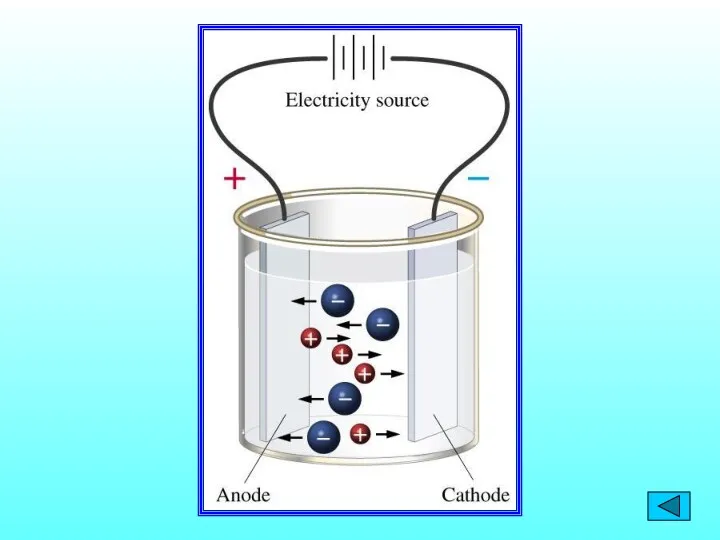
Кислород. Общая характеристика, получение и свойства Электролиз
Электролиз Кислород и озон
Кислород и озон Получение и приминение этилена
Получение и приминение этилена Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва
Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Решение задач. Органическая химия
Решение задач. Органическая химия Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Нуклеиновые кислоты
Нуклеиновые кислоты Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции V и III группы периодической системы элементов Д.И. Менделеева
V и III группы периодической системы элементов Д.И. Менделеева Қатты әсер ететін уландырғыш заттар
Қатты әсер ететін уландырғыш заттар Органические и неорганические кислоты
Органические и неорганические кислоты