Содержание
- 2. Опыт. В стеклянном стакане смешивают равные объемы растворов нитрата свинца (II) и йодида калия. Сразу же
- 3. Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь,
- 5. Положения координационной теории Вернера в центре комплексного соединения находится центральный ион – комплексообразователь. Комплексообразователь (центральный атом)
- 7. Вокруг центрального иона-комплексообразователя находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (от латинского "ligare"
- 8. Комплексные соединения - это соединения, которые содержат катионный, анионный или нейтральный комплекс, состоящий из центрального атома
- 9. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. 2+ 0 2+ 2- [Cu(NH3)4] SO4
- 10. ЦЕНТРАЛЬНЫЙ АТОМ (ион-комплексообразователь) Ионами –коплексообразователями являются катионы металлов, а также некоторые неметаллы, например В, Р, Si.
- 12. Координационное число не является неизменной величиной. Даже для одних и тех же комплексообразователей и лигандов координационное
- 13. ЛИГАНДЫ - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем. Лигандами
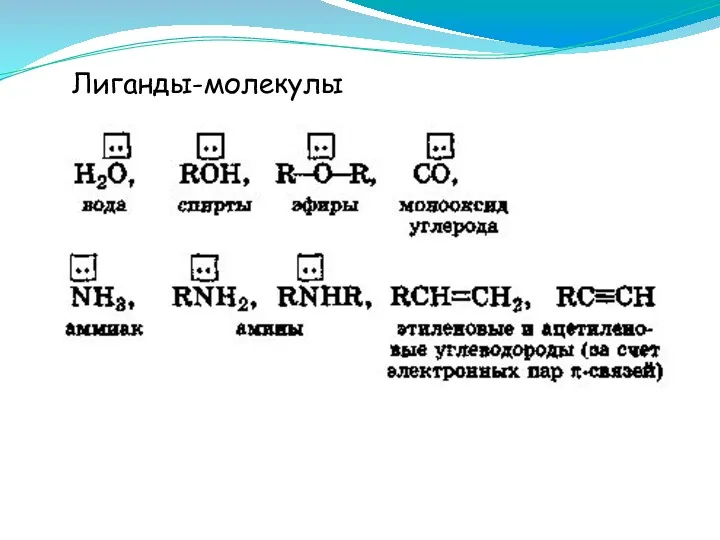
- 14. Лиганды-молекулы
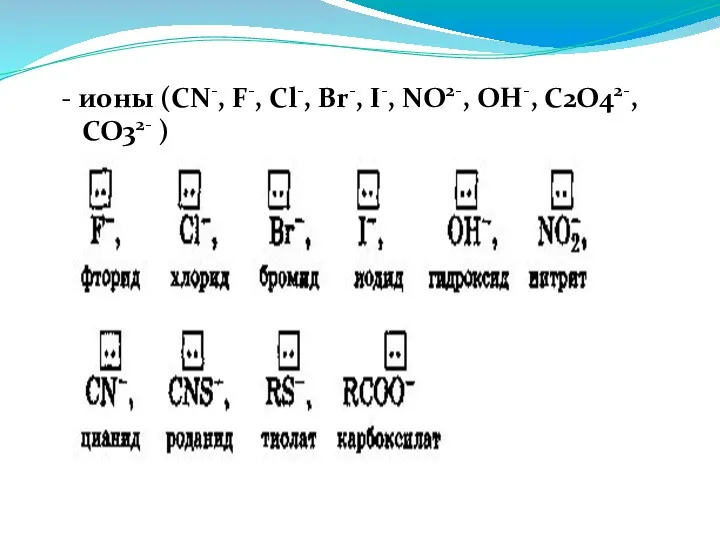
- 15. - ионы (CN-, F-, Cl-, Br-, I-, NO2-, OH-, C2O42-, CO32- )
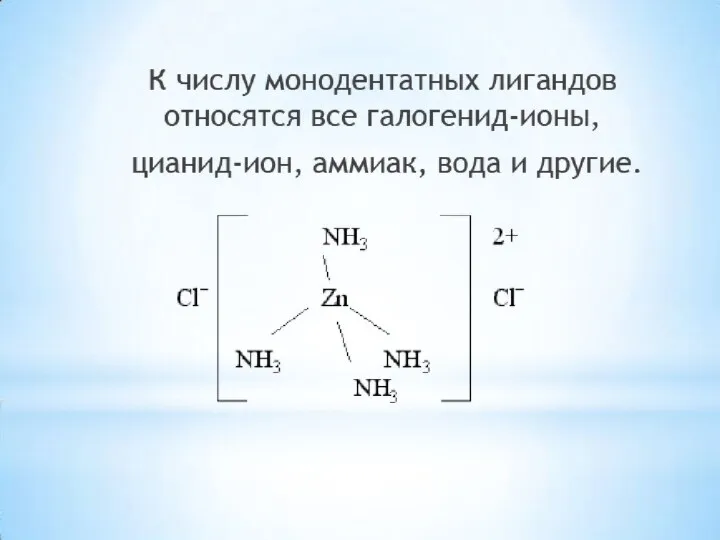
- 16. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные лиганды, занимающие
- 20. Природа химической связи в комплексных соединениях Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи,
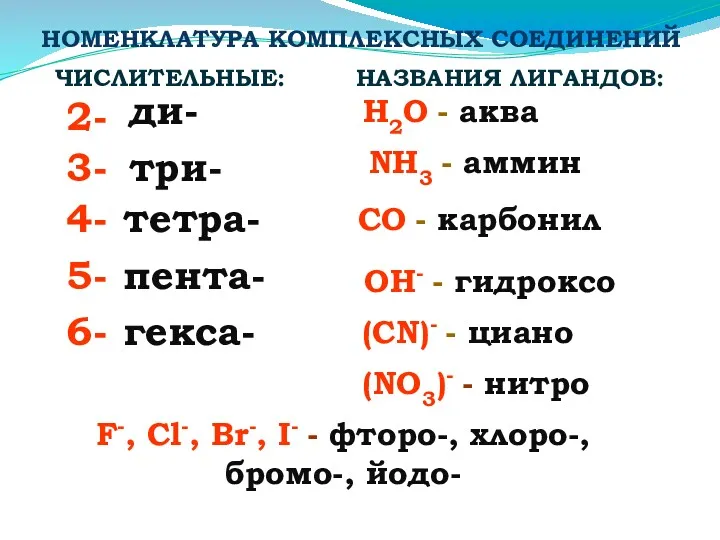
- 23. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 24. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ комплексообразователей (лат.): Fe - феррат Cu - купрат Ag - аргентат Au
- 25. Соль содержит комплексный катион [Cо(NH3)4Cl2]Cl -называют анион соли (хлорид); -называют входящие во внутреннюю сферу лиганды-анионы с
- 26. Соль содержит комплексный анион K4[Fe(CN)6] -называют лиганды-анионы с окончанием на «о» с указанием их количества (гексациано);
- 27. Нейтральный комплекс [Co2(CO)8] -названия комплексов без внешней сферы состоят из одного слова; -указывается число и названия
- 28. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
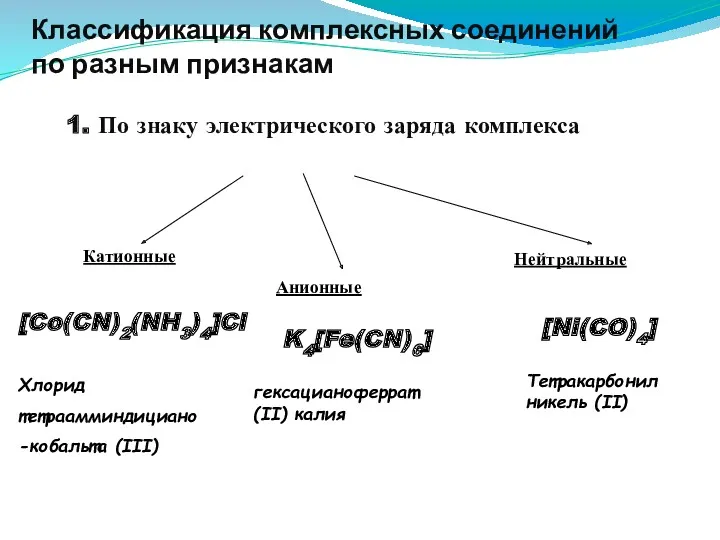
- 29. Классификация комплексных соединений по разным признакам 1. По знаку электрического заряда комплекса 2. Принадлежности к определённому
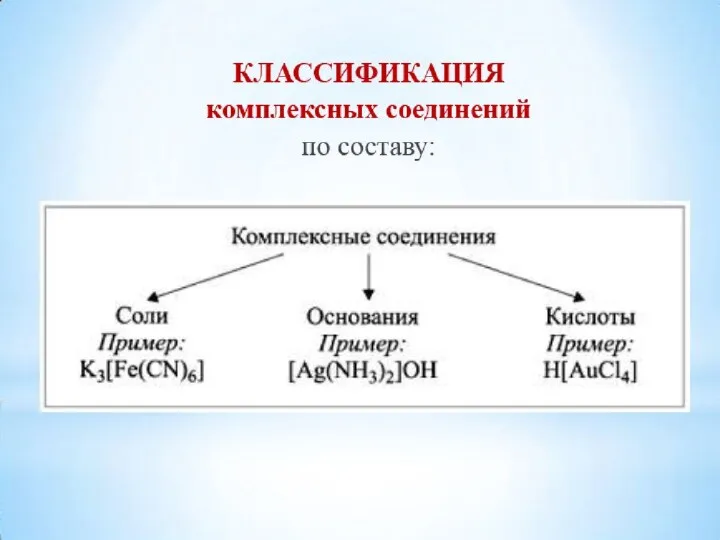
- 30. 2. По принадлежности к определённому классу соединений комплексные диамминсеребро(I) гидрооксид кислоты основания соли H[AuCl4] [Ag(NH3)2]OH K2[HgI4]
- 31. По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3,
- 32. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. K2[PtCl4], H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы —
- 38. Чем меньше константа диссоциации, тем устойчивее комплекс. Чем больше константа устойчивости, тем устойчивее комплекс. На прочность
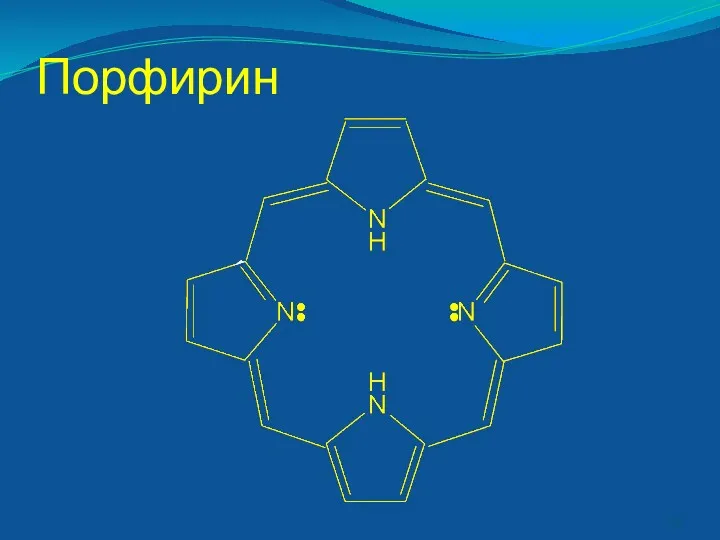
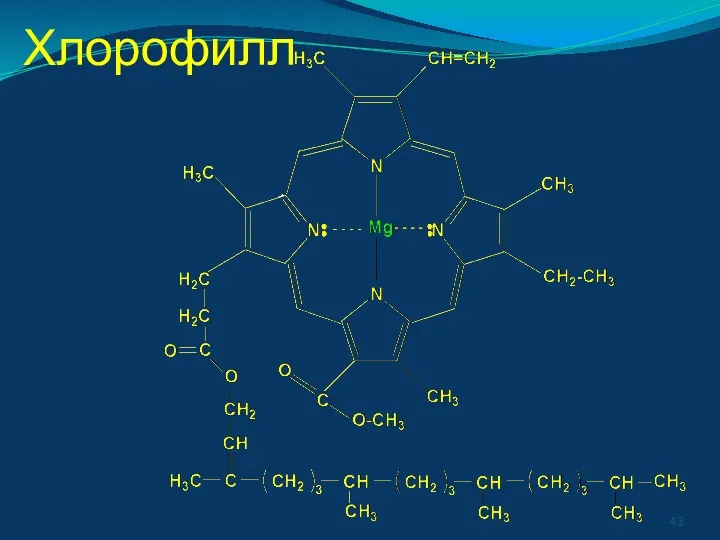
- 41. В живых организмах в полидентных лигандах донорные атомы связаны в единое кольцо-цикл. - порфирины [железо в
- 42. Порфирин
- 43. Хлорофилл
- 44. Гемоглобин
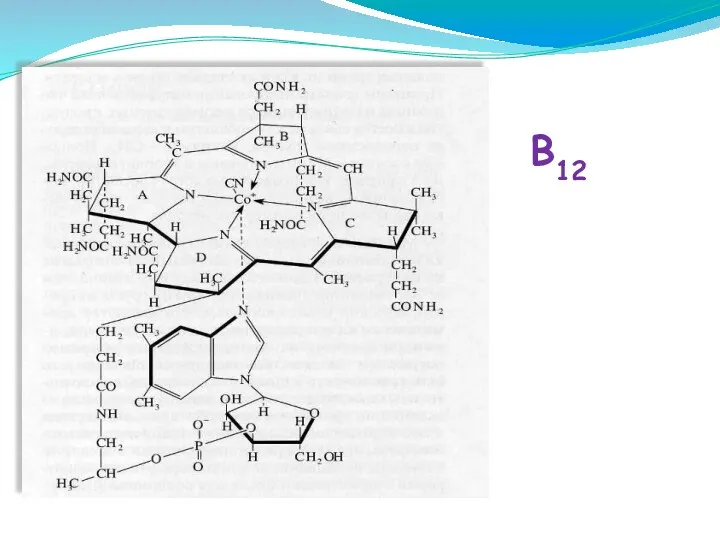
- 45. B12
- 46. Полидентные лиганды связываются с ионами металла гораздо сильнее, чем монодентные с теми же донорными атомами [прочность
- 47. ……. Изомерия комплексных соединений. 1. Сольватная [гидратная]: различие в распределении воды во внутренней и внешней сфере:
- 48. Комплексообразователи и лиганды нашего организма. Ca 2+ - [Na+ и К+] присутствуют в основном в свободном
- 49. Общие понятия об активном центре металлоферментов. ферменты представляют собой комплексные соединения с металлами, ионы которых определяют
- 50. Значение комплексов в медицине. Биохимик Дж.Вуд писал:. Биохимия — это координационная химия живых систем». В медицине
- 52. Скачать презентацию



















![Соль содержит комплексный катион [Cо(NH3)4Cl2]Cl -называют анион соли (хлорид); -называют](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223136/slide-24.jpg)
![Соль содержит комплексный анион K4[Fe(CN)6] -называют лиганды-анионы с окончанием на](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223136/slide-25.jpg)
![Нейтральный комплекс [Co2(CO)8] -названия комплексов без внешней сферы состоят из](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223136/slide-26.jpg)
![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223136/slide-27.jpg)













![……. Изомерия комплексных соединений. 1. Сольватная [гидратная]: различие в распределении](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223136/slide-46.jpg)



 Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Газовые гидраты
Газовые гидраты Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Моющие средства
Моющие средства Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Алюминий и его соединения
Алюминий и его соединения Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Термический анализ
Термический анализ Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Кислород и оксиген
Кислород и оксиген Нитраттарды қолдану
Нитраттарды қолдану Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Металлы и сплавы. Общие сведения о металлах и сплавах
Металлы и сплавы. Общие сведения о металлах и сплавах Элементы VIА группы
Элементы VIА группы Химическая промышленность
Химическая промышленность Основные классы неорганических соединений
Основные классы неорганических соединений Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Нуклеиновые кислоты
Нуклеиновые кислоты Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі
Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі Карбоновые кислоты
Карбоновые кислоты Ауыр түсті металдар
Ауыр түсті металдар