Содержание
- 2. Вопросы входного контроля знаний: Дайте определения терминам: Атом; Молекула; Химическая связь; Энтропия; Энтальпия; Энергия Гиббса; Энергия
- 3. Химическая связь и строение молекул
- 4. Моле́кула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов. А́том (от
- 5. Химическая связь – это совокупность электронно-ядерных взаимодействий, приводящих к минимуму потенциальной энергии системы. Энергия ХС равна
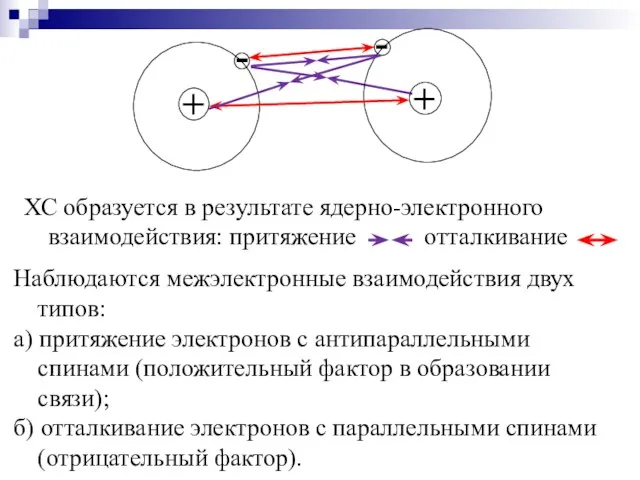
- 6. ХС образуется в результате ядерно-электронного взаимодействия: притяжение отталкивание Наблюдаются межэлектронные взаимодействия двух типов: а) притяжение электронов
- 7. Термодинамика процесса образования химической связи (ХС). Энтальпийный фактор Энтропийный фактор Процесс самопроизвольный, т.е. энергия Гиббса ∆
- 8. Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это
- 9. ∆ G Основной причиной образования химических связей между атомами с образованием молекулы является понижение полной энергии
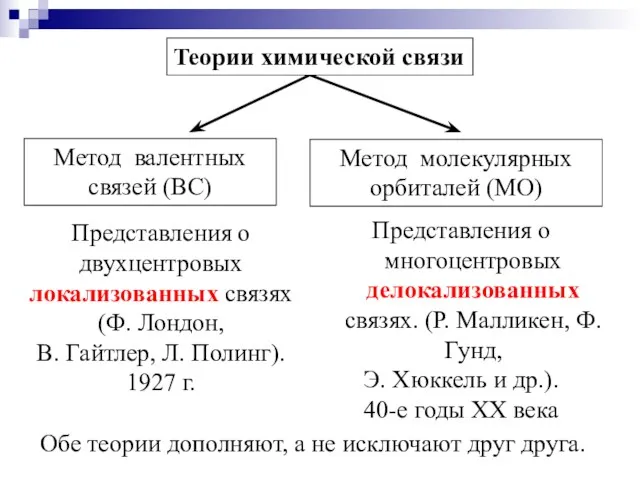
- 10. Метод валентных связей (ВС) Метод молекулярных орбиталей (МО) Представления о двухцентровых локализованных связях (Ф. Лондон, В.
- 11. Основные положения теории валентных связей 1. ХС между атомами образуется в результате обобществления валентных электронов, т.е.
- 12. 5. В пространстве ХС располагается в том направлении, в котором возможность перекрывания АО наибольшая. 6. ХС,
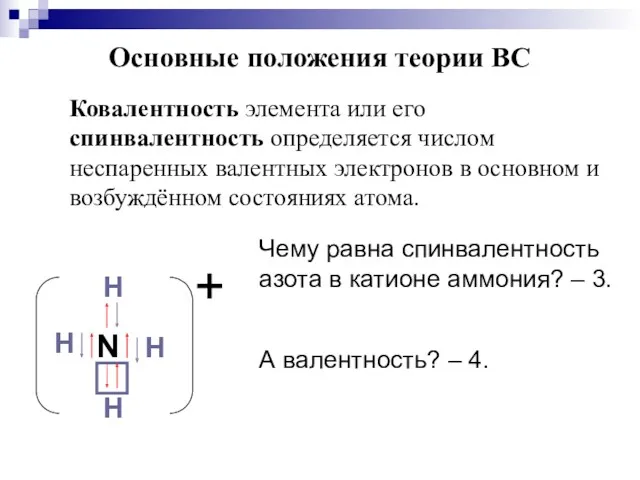
- 13. Ковалентность элемента или его спинвалентность определяется числом неспаренных валентных электронов в основном и возбуждённом состояниях атома.
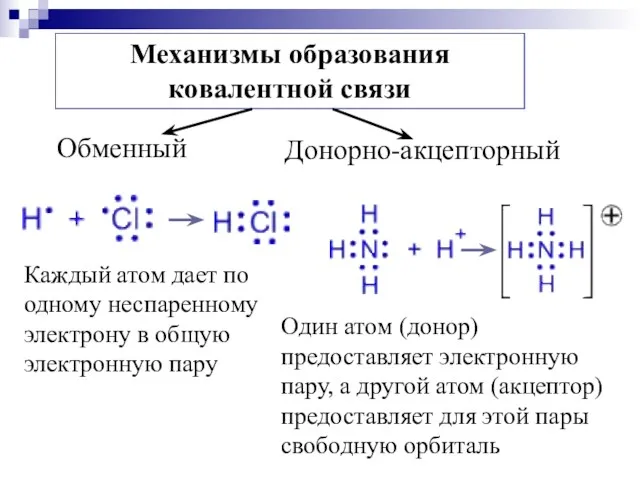
- 14. Каждый атом дает по одному неспаренному электрону в общую электронную пару Один атом (донор) предоставляет электронную
- 15. Свойства ковалентной химической связи 1. Энергия связи 2. Длина связи 3. Кратность связи 4. Насыщаемость 5.
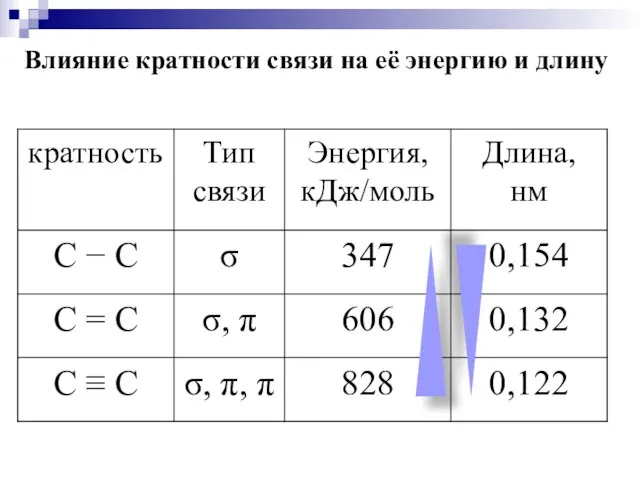
- 16. Влияние кратности связи на её энергию и длину
- 17. Насыщаемость связи – … II период – макс. валентность не более IV III период (s- и
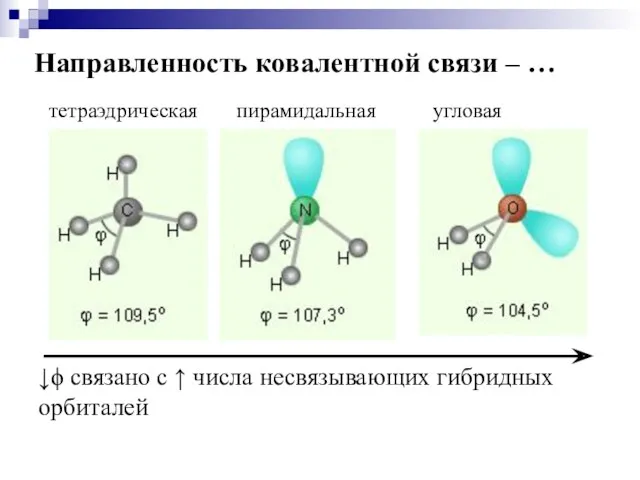
- 18. Направленность ковалентной связи – …
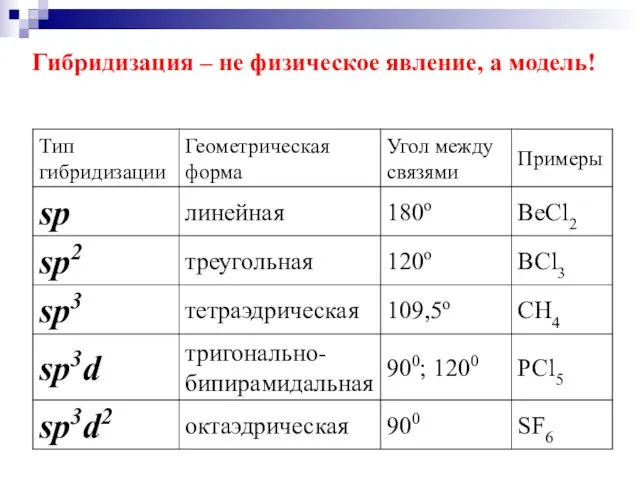
- 19. Гибридизация – не физическое явление, а модель!
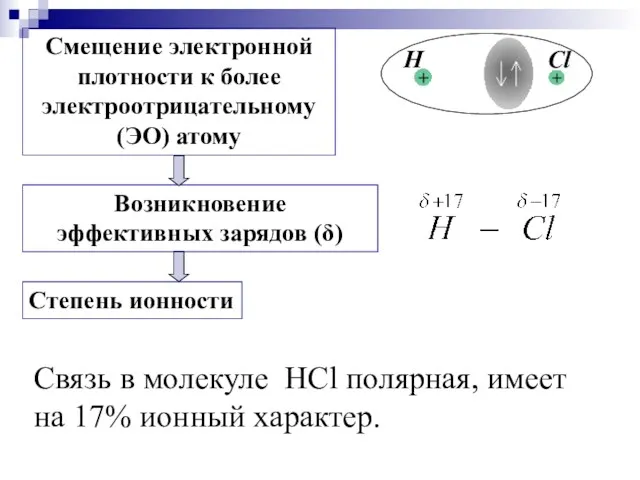
- 20. Полярность связи – … Чем ↑Δ ОЭО, тем ↑ полярность х.с Если ΔОЭО = 0 ,
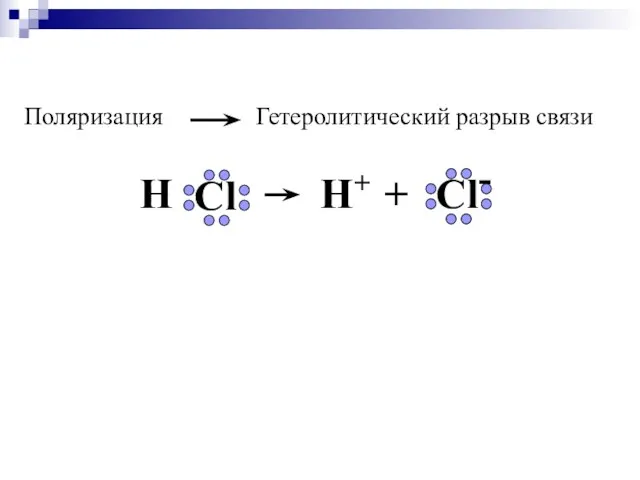
- 21. Cвязь в молекуле HCl полярная, имеет на 17% ионный характер.
- 22. т.е., степень ионности равна 83%. Полного перетягивания связующих пар электронов от более электроположительного к более электроотрицательному
- 23. Дипольный момент связи (μ) Эффективный заряд Длина связи
- 24. Неполярные молекулы Молекула неполярна, если суммарный μ всех связей = 0.
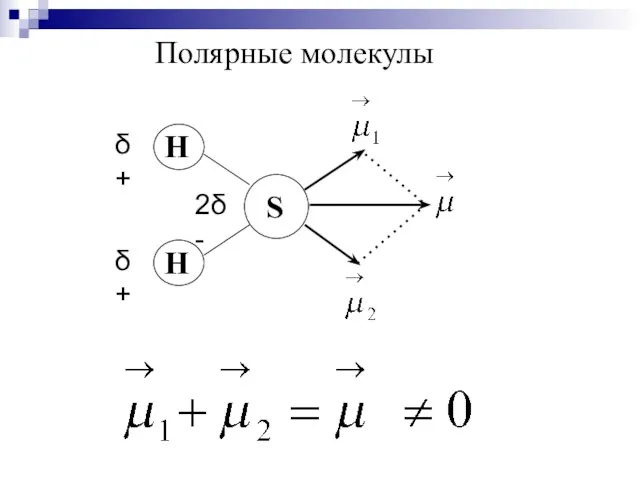
- 25. Полярные молекулы
- 26. Дипольный момент молекулы зависит от: ∙ полярности связей; ∙ геометрии молекулы; ∙ наличия неподелёных пар электронов.
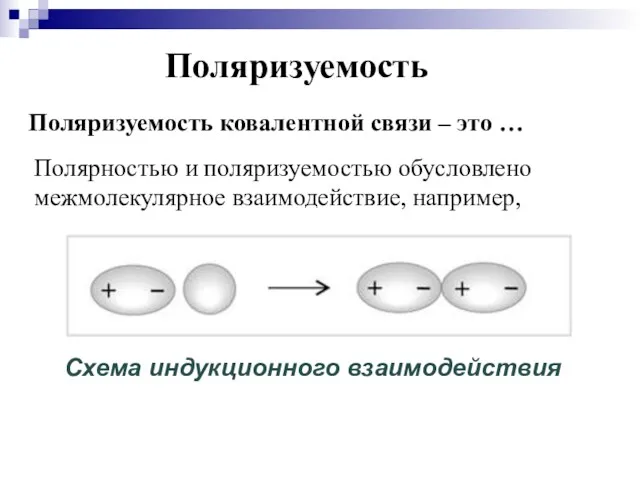
- 27. Поляризуемость Поляризуемость ковалентной связи – это … Полярностью и поляризуемостью обусловлено межмолекулярное взаимодействие, например,
- 28. HCl HBr HI ΔЭО: 0,9 0,7 0,5 Полярность связи уменьшается Поляризуемость увеличивается
- 30. Водородная связь
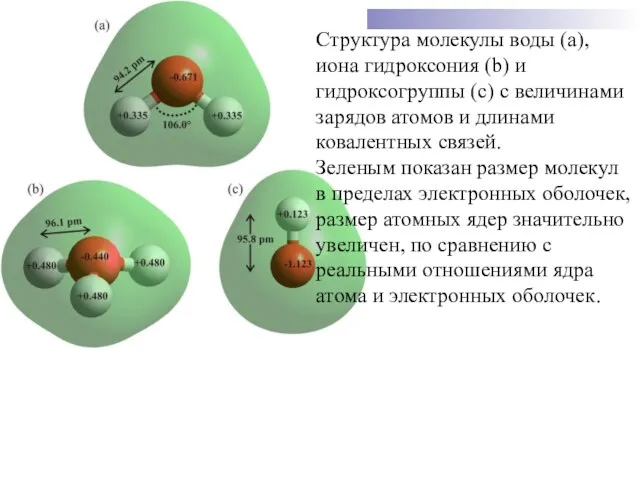
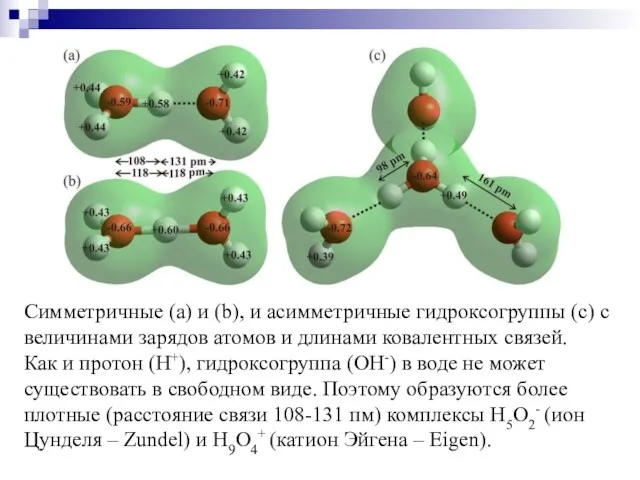
- 31. Структура молекулы воды (а), иона гидроксония (b) и гидроксогруппы (с) с величинами зарядов атомов и длинами
- 32. Симметричные (а) и (b), и асимметричные гидроксогруппы (с) с величинами зарядов атомов и длинами ковалентных связей.
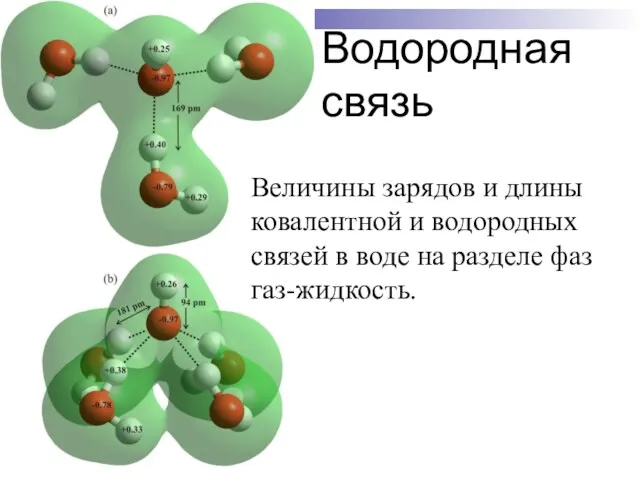
- 33. Водородная связь Величины зарядов и длины ковалентной и водородных связей в воде на разделе фаз газ-жидкость.
- 34. Взаимодействие между молекулами НХ: сильно ЭО элемент: F, O, N, (Cl, S ) Водородные связи могут
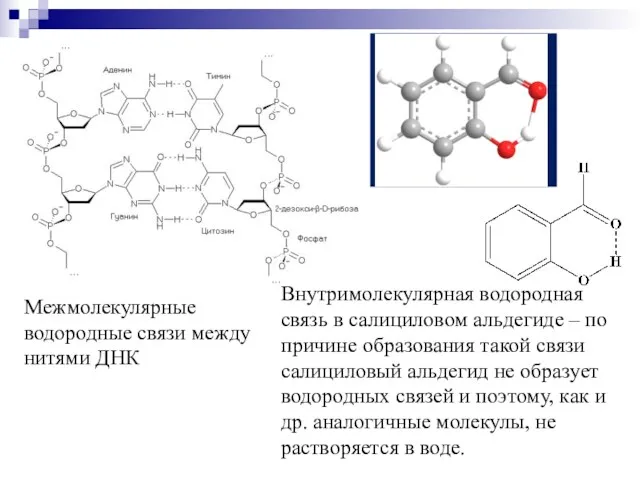
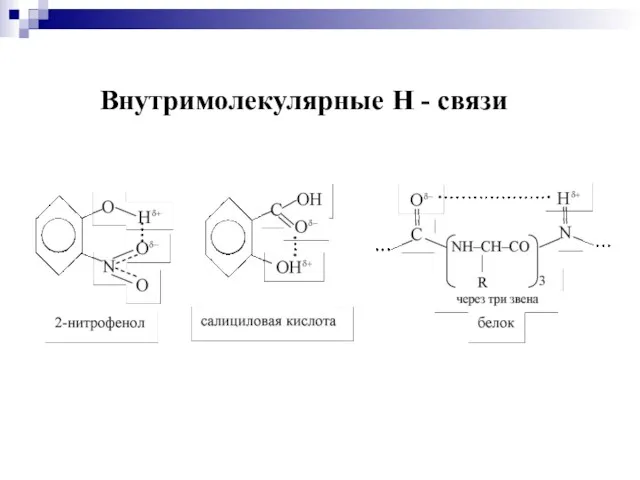
- 35. Межмолекулярные водородные связи между нитями ДНК Внутримолекулярная водородная связь в салициловом альдегиде – по причине образования
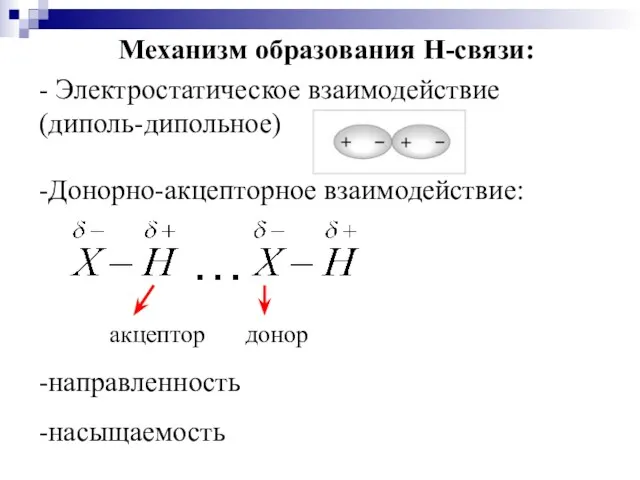
- 36. Механизм образования Н-связи: - Электростатическое взаимодействие (диполь-дипольное) -Донорно-акцепторное взаимодействие: -направленность -насыщаемость
- 37. Туннельные эффекты при образовании Н-связи: Туннельный эффект (туннелирование, ТЭ) – прохождение частицы (или системы частиц) сквозь
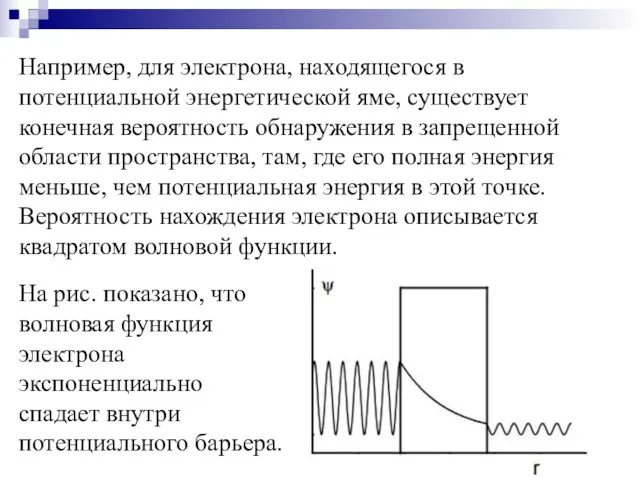
- 38. Например, для электрона, находящегося в потенциальной энергетической яме, существует конечная вероятность обнаружения в запрещенной области пространства,
- 39. Туннельные эффекты при образовании Н-связи: ТЭ при образовании водородной связи, возможно, наблюдается в трехмерной сетке водородных
- 40. В 1805 г. Теодор Гротгус выдвинул первое правильное теоретическое объяснение разложения воды электрическим током и сформулировал
- 41. Есвязи, кДж/моль ковалентная 100-400 водородная 4-50 межмолекулярная 0,1 -5 Энергия Н-связи
- 42. Внутримолекулярные Н - связи
- 43. Основные положения метода молекулярных орбиталей (ММО) 1. При образовании молекулы по ММО изменяют своё состояние не
- 44. 3.Для получения МО используют метод линейной комбинации атомных орбиталей МЛКАО. Из двух АО разных атомов образуется
- 45. 6. Химическая связь в ММО характеризуется энергией связи и кратностью. Кратность связи (р) определяется по формуле:
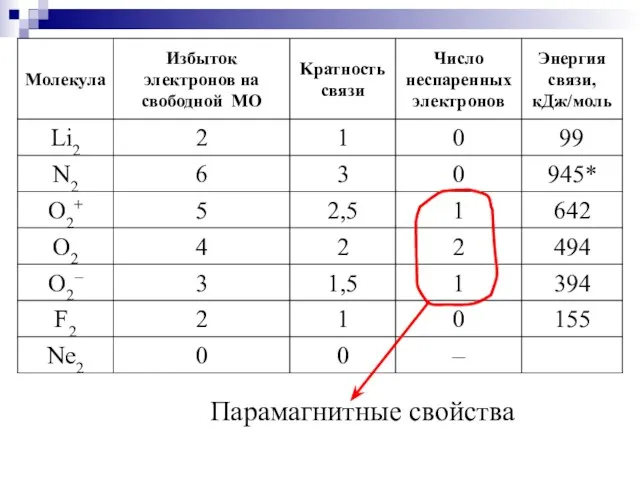
- 46. Наличие спаренных или неспаренных электронов в атомах, молекулах и кристаллах устанавливается экспериментально путем изучения магнитных свойств
- 47. Парамагнитные свойства
- 48. Сравнительная характеристика методов: ВС и МО ВС достоинства: нагляден; описывает геометрию молекул недостатки: ∙ не рассматривает
- 49. МО достоинства: ∙ общий подход при описании всех химических соединений; Выбор метода определяется объектом исследования и
- 50. Основные положения теории систем (синергетика)
- 51. Система – это совокупность элементов или отношений, закономерно связанных друг с другом в единое целое, которое
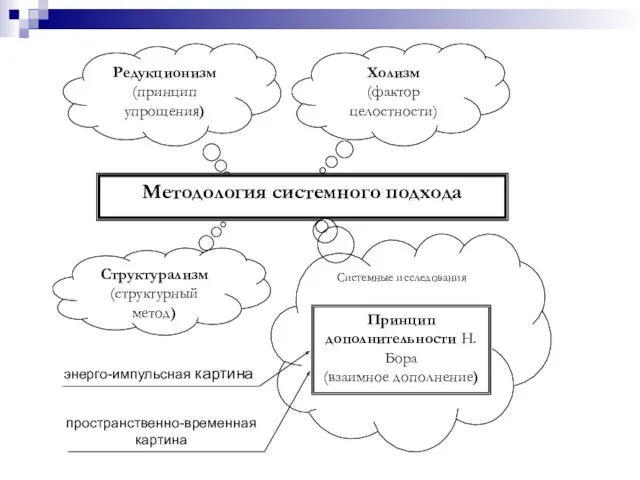
- 52. Редукционизм (принцип упрощения) Холизм (фактор целостности) Методология системного подхода Структурализм (структурный метод) Системные исследования Принцип дополнительности
- 53. Редукция – упрощение, сведение более сложного к простому, обозримому, понимаемому, более доступному для анализа или решения,
- 54. Эмерджентность: 1 + 1 ≠ 2 От англ. emergent — возникающий, неожиданно появляющийся, в теории систем
- 55. Основные принципы синергетики Природа иерархически структурирована в несколько видов открытых нелинейных систем разных уровней организации: в
- 56. Основные принципы синергетики Общее для всех эволюционирующих систем: неравновесность, спонтанное образование новых микроскопических (локальных) образований, изменения
- 57. Основные принципы синергетики В сильно неравновесных состояниях системы начинают воспринимать те факторы воздействия извне, которые они
- 58. Синергетика объясняет процесс самоорганизации в сложных системах следующим образом: Система должна быть открытой. Закрытая система в
- 59. Синергетика объясняет процесс самоорганизации в сложных системах следующим образом: Фундаментальным принципом самоорганизации служит возникновение нового порядка
- 60. Синергетика объясняет процесс самоорганизации в сложных системах следующим образом: Самоорганизация, имеющая своим исходом образование через этап
- 61. Синергетика объясняет процесс самоорганизации в сложных системах следующим образом: Этап самоорганизации наступает только в случае преобладания
- 62. Синергетика объясняет процесс самоорганизации в сложных системах следующим образом: Самоорганизация в сложных системах, переходы от одних
- 63. Самоорганизация в супрамолекулярных системах обусловлена: Различными видами электростатического взаимодействия макромолекул по принципам комплементарности и трехмерной конгруэнтности
- 64. Движущие силы самоорганизации молекул и образование супрамолекулярных систем Для образования устойчивой супрамолекулярной системы (комплексов, агрегатов, кластеров)
- 65. Виды самоорганизации молекул Самоорганизация путем распознавания: Структура гость-хозяин Пример – субстрат в активном центре фермента Наведенное
- 66. Виды самоорганизации молекул Самосборка комплементарных молекул: Пример – образование двойной нити ДНК. При нагревании (плавлении) ДНК
- 67. Виды самоорганизации молекул Самосборка молекулярных кристаллов: Пример – образование тубулиновых микрофиламентов и амилоида. Структурные единицы (короткоцепочечные
- 68. Виды самоорганизации молекул Внутримолекулярная перестройка: Пример – образование амилоида и прионовых белков. В условиях неблагоприятного молекулярного
- 69. Литература для самоподготовки Молекулярная биология клетки : рук-во для врачей / Фаллер, Джеральд. – М. :
- 71. Скачать презентацию
















































 Строение атома
Строение атома Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр Кислоты. 8 класс
Кислоты. 8 класс Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Кислоты. Состав кислот
Кислоты. Состав кислот Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Органические соединения амины
Органические соединения амины Алюминий и его соединения
Алюминий и его соединения Комплексные соединения. Определения
Комплексные соединения. Определения Кристаллические и аморфные тела
Кристаллические и аморфные тела Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Основные характеристи нефти и нефтеподуктов
Основные характеристи нефти и нефтеподуктов Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Теорія горіння та вибуху
Теорія горіння та вибуху Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гідроліз солей
Гідроліз солей Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Алюминий
Алюминий Платина. Физические и химические свойства
Платина. Физические и химические свойства Урок 25
Урок 25 Plastics слайды
Plastics слайды Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă
Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă Определение фосфатов, железа, хлоридов
Определение фосфатов, железа, хлоридов Азотная кислота
Азотная кислота Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения