Слайд 2
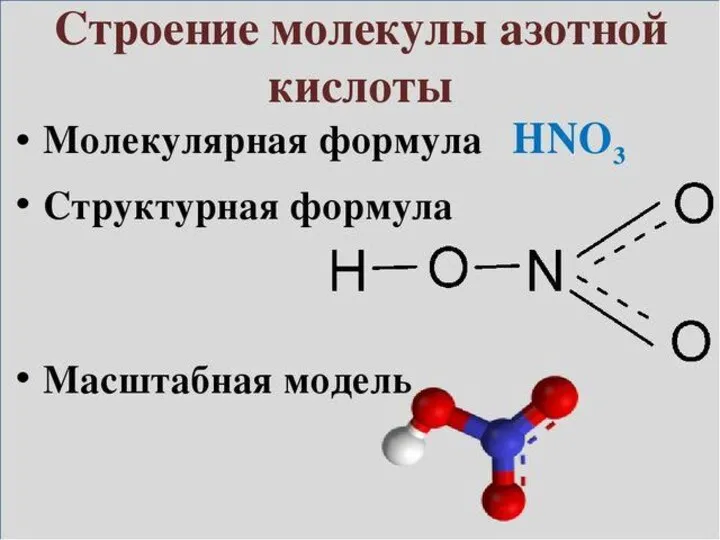
Слайд 3

Физические и химические свойства
Азотная кислота – бесцветная гигроскопичная жидкость, c резким
запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + 2H2O + O2.
Азотная кислота ядовита.
Слайд 4

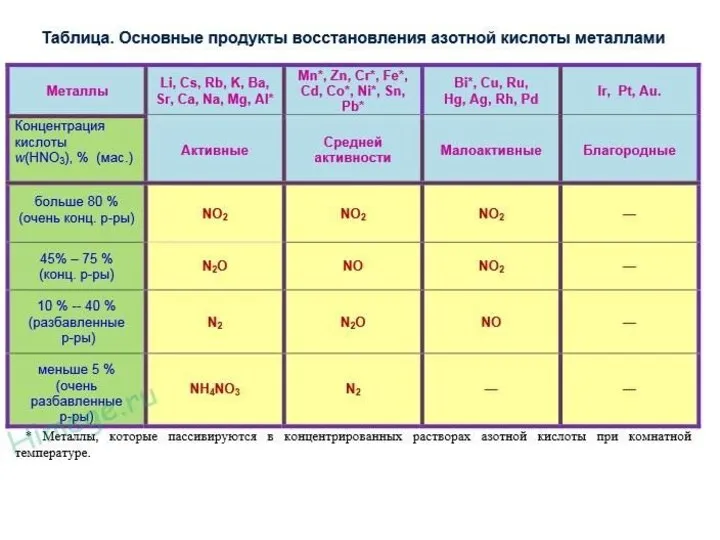
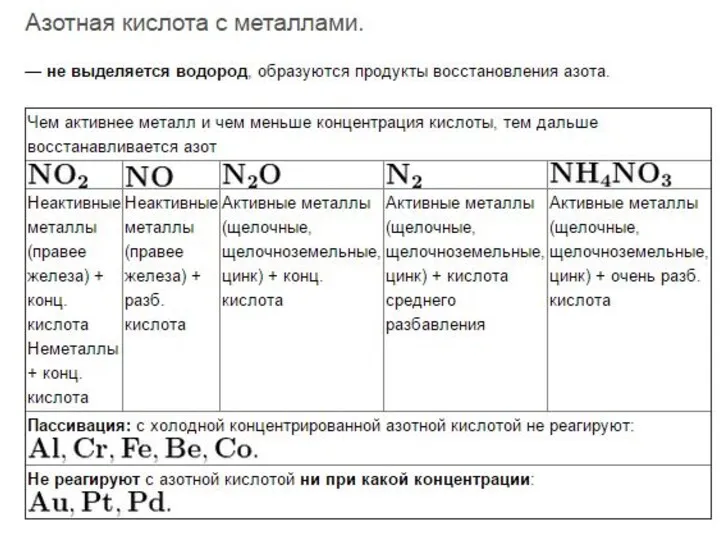
Взаимодействие азотной кислоты с металлами
Независимо от концентрации окислителем в азотной кислоте
являются нитрат-ионы NO3, содержащие азот в степени окисления +5. Поэтому при взаимодействии металлов с азотной кислотой водород не выделяется. Азотная кислота окисляет все металлы за исключением самых неактивных (благородных). При этом образуются соль, вода и продукты восстановления азота (+5): NH−34 NO3, N2, N2O, NO, НNО2, NO2. Свободный аммиак не выделяется, так как он взаимодействует с азотной кислотой, образуя нитрат аммония:
NH3 + HNO3 = NH4NO3
Слайд 5

При взаимодействии металлов с концентрированной азотной кислотой (30–60 % HNO3) продуктом
восстановления HNO3 является преимущественно оксид азота (IV), независимо от природы металла, например:
Mg + 4HNO3(конц.) = Mg(NO3)2 + 2NO2↑ + 2H2O
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
Hg + 4HNO3(конц.) = Hg(NO3)2 + 2NO2↑ + 2H2O
Слайд 6

Металлы переменной валентности при взаимодействии с концентрированной азотной кислотой окисляются до
высшей степени окисления. При этом те металлы, которые окисляются до степени окисления +4 и выше, образуют кислоты или оксиды. Например:
Sn + 4HNO3(конц.) = H2SnO3 + 4NO2↑ + H2O
2Sb + 10HNO3(конц.) = Sb2O5 + 10NO2↑ + 5H2O
Мо + 6HNO3(конц.) = H2МоO4 + 6NO2↑ + 2H2O
Слайд 7

В концентрированной азотной кислоте (холодной) пассивируются алюминий, хром, железо, никель, кобальт,
титан и некоторые другие металлы. После обработки азотной кислотой эти металлы не взаимодействуют и с другими кислотами.
Слайд 8

2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотойобразуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
Слайд 9

При взаимодействии металлов с разбавленной азотной кислотой продукт её восстановления зависит
от восстановительных свойств металла: чем активнее металл, тем в большей степени восстанавливается азотная кислота.
Активные металлы восстанавливают разбавленную азотную кислоту максимально, т.е. образуются соль, вода и NH4NO3, например:
8K + 10HNO3(разб.) = 8КNO3 + NН4NO3 + 3H2O
Металлы средней активности при взаимодействии с разбавленной азотной кислотой образуют соль, воду и азот или N2O. Чем левее металл в этом интервале (чем ближе к алюминию), тем вероятнее образование азота, например:
5Мn + 12HNO3(разб.) = 5Mn(NO3)2 + N2↑ + 6H2O
4Cd + 10HNO3(разб.) = 4Cd(NO3)2 + N2O↑ + 5H2O
Слайд 10

Малоактивные металлы при взаимодействии с разбавленной азотной кислотой образуют соль, воду
и оксид азота (II), например:
3Сu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Чем выше активность металла и ниже концентрация кислоты, тем ниже степень окисления азота в том продукте.
Слайд 11
Слайд 12
Слайд 13

Слайд 14
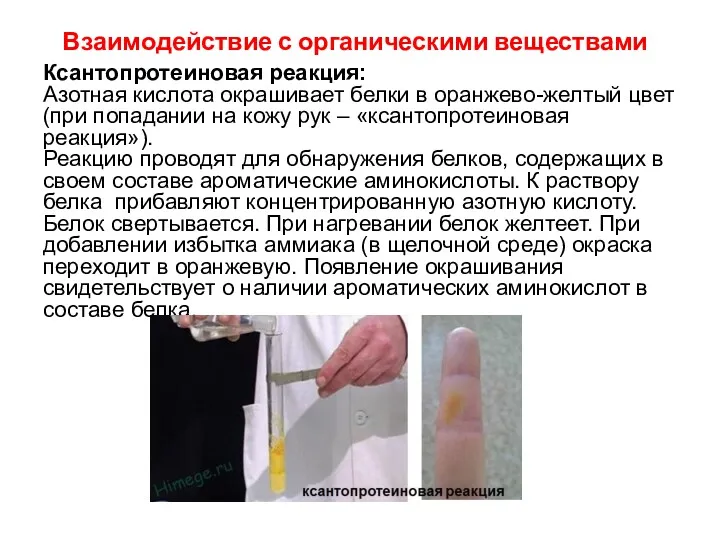
Взаимодействие с органическими веществами
Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет
(при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
Слайд 15















 Калийные удобрения
Калийные удобрения Мінерали та гірські породи
Мінерали та гірські породи Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Железо. Нахождение в природе. Свойства железа
Железо. Нахождение в природе. Свойства железа Многоатомные спирты
Многоатомные спирты Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Основные законы и понятия химии
Основные законы и понятия химии Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Химия нефти и газа
Химия нефти и газа Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Комплексные соединения
Комплексные соединения Химический элементы в нашей жизни
Химический элементы в нашей жизни Валентность химических элементов
Валентность химических элементов Цинк и его соединения
Цинк и его соединения Золото. Виды золота
Золото. Виды золота Серная кислота и её свойства
Серная кислота и её свойства Классификация и свойства оксидов
Классификация и свойства оксидов Минерал лазурит. Месторождения
Минерал лазурит. Месторождения Альдегидтер мен спирттер
Альдегидтер мен спирттер Легированные стали
Легированные стали Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Фосфор и его соединения. 9 класс
Фосфор и его соединения. 9 класс Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов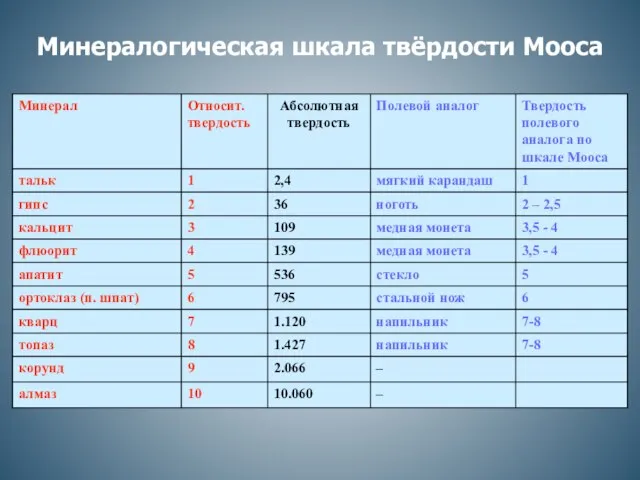 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса