Содержание
- 2. Литература Коржуков Н.Г. Общая химия. 2001 г. 2. Коржуков Н.Г. Общая и неорганическая химия. 2004 г.
- 3. Aтомно-молекулярная теория Атомно-молекулярная теория Принята в 1860 г. на I Международном химическом конгрессе в г.Карлсруэ (Германия)
- 4. ЗАКОН СОХРАНЕНИЯ МАССЫ ( открытие принадлежит М.В.Ломоносову и Лавуазье) Масса всех веществ, вступающих в химическую реакцию,
- 5. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ Энергия изолированной системы постоянна nр ⋅ mр + nn ⋅ mn 22688 Ra
- 6. ЗАКОН ПОСТОЯНСТВА СОСТАВА (открыт французским химиком Прустом в 1799 г.) Все соединения содержат элементы в строго
- 7. ЗАКОН ПОСТОЯНСТВА СОСТАВА Вещества, строго следующие закону постоянства состава, называются дальтонидами. Например, Н2О. Те вещества, которые
- 8. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1. АТОМ, АТОМНЫЙ ИОН 2. ХИМИЧЕСКИЙ ЭЛЕМЕНТ 3. МОЛЕКУЛА, МОЛЕКУЛЯРНЫЙ ИОН 4. ВЕЩЕСТВО
- 9. Кислород (О) ~ 47% по массе; Кремний (Si) ~ 27% Al, Fe, Ca, Na, K, Mg,
- 10. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ МАССЫ mAl = 4,5 ⋅ 10-23 г mC = 2 ⋅ 10-23 г
- 11. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ МАССЫ Относительная молекулярная масса вещества (Мr) – это безразмерная величина, равная отношению массы
- 12. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ МАССЫ Молярная масса (М) – это масса 1 моля вещества [г/моль] М =
- 13. Стехиометрические соотношения в химии Стехиометрия – раздел химии, изучающий объемные и массовые соотношения между реагирующими веществами.
- 14. ЭКВИВАЛЕНТ Грамм-эквивалент–это эквивалент, выраженный в граммах. Эквивалент элемента Ээлемента = Аr/B где Аr – относительная атомная
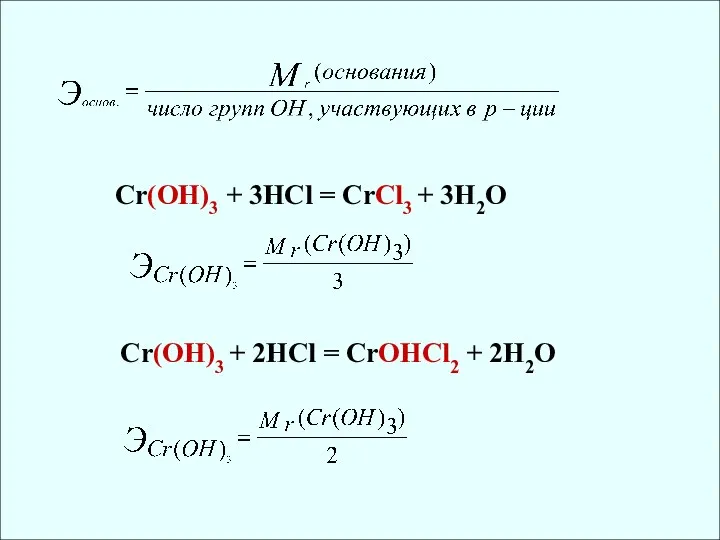
- 15. ЭКВИВАЛЕНТЫ СЛОЖНЫХ ВЕЩЕСТВ Эквивалент основания равен относительной молекулярной массе, деленной на кислотность основания NaOH: Э =
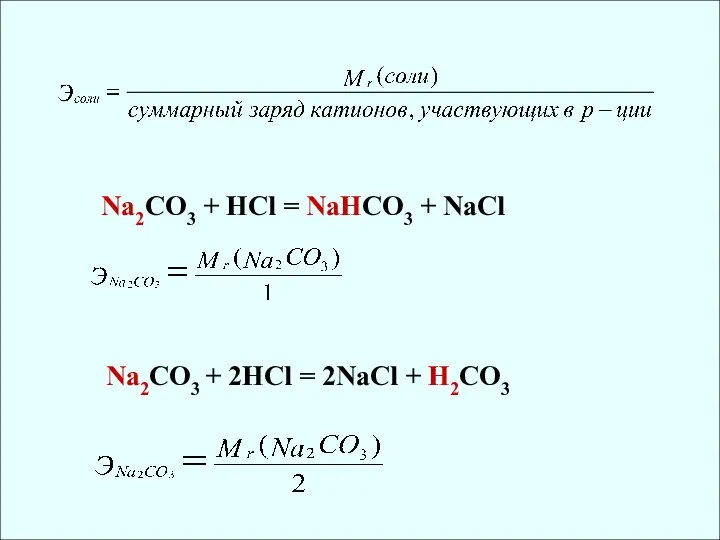
- 16. ЭКВИВАЛЕНТЫ СЛОЖНЫХ ВЕЩЕСТВ Эквивалент соли равен относительной молекулярной массе, деленной на суммарный заряд катиона NaCl: Э
- 17. ЗАКОН ЭКВИВАЛЕНТОВ ∙ Массы реагирующих веществ относятся как их эквиваленты m1 / m2=Э1 / Э2 ∙
- 18. В химических реакциях H2SO4 + NaOH = NaHSO4 + H2O H2SO4 + 2NaOH = Na2SO4 +
- 19. Cr(OH)3 + 3HCl = CrCl3 + 3H2O Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O
- 20. Na2CO3 + HCl = NaHCO3 + NaCl Na2CO3 + 2HCl = 2NaCl + H2CO3
- 21. Эоксида в обменных и кислотно-основных реакциях CO2 + NaOH = NaHCO3 СО2 + 2NaOH = Na2CO3
- 22. Газовые законы 1.Закон Авогадро и его следствия 2. Закон Бойля-Мариотта 3. Закон Гей-Люссака 4. Закон Шарля
- 23. ЗАКОН АВОГАДРО (Авогадро – итальянский физик и химик, закон открыт в 1811 г.) ∙ В равных
- 24. Эквивалентный объём водорода и кислорода при н.у.: 2 г Н2 22,4 л 1 г Н2
- 25. Р -V = const (при T – const) V / T = const (при P –
- 26. Объединенный (универсальный) газовый закон PV/ T= const Для 1 моля газа постоянная называется универсальной газовой постоянной
- 27. Уравнение Клапейрона-Менделеева Если объем газа задан при других условиях, то его следует привести к н.у. по
- 28. Определение молекулярной массы газа или пара 1. По измерениям массы (m) и объема (V) газа при
- 29. Определение молекулярной массы газа или пара 2. По относительной плотности Относительная плотность первого газа по второму
- 31. Скачать презентацию


























 Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Ионные уравнения реакции
Ионные уравнения реакции Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Химический состав земной коры
Химический состав земной коры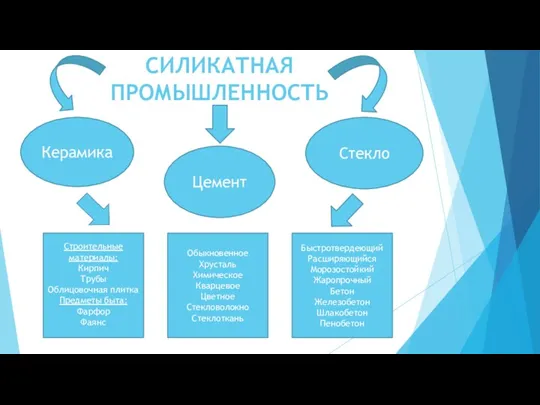 Силикатная промышленность
Силикатная промышленность Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Азотовмісні сполуки
Азотовмісні сполуки Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Кислоты. Классификация кислот
Кислоты. Классификация кислот Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Сущность процесса электролиза
Сущность процесса электролиза Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Каучук. Открытие каучука
Каучук. Открытие каучука Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли