Содержание
- 2. Протекающая реакция описывается следующим уравнением 2KOH + H2SO4 = K2SO4 + 2H2O
- 3. 2KOH + H2SO4 = K2SO4 + 2H2O Отражает ли эта запись в истинном свете проведенную реакцию?
- 4. В растворе ионы 2KOH = 2K+ + 2OH- H2SO4 = 2H+ + SO42- K2SO4 = 2K+
- 5. Поэтому реакция записывается в ионном виде 2K+ +2OH- +2H+ +SO42- = = 2K+ + SO42- +
- 7. Реакция нейтрализации между H2SO4 и Ba(OH)2 это другая реакция, так как в результате образуется нерастворимая соль
- 8. Молекулярное уравнение H2SO4 + Ba(OH)2 = = BaSO4↓ + 2H2O Ионный вид 2H+ + SO42- +
- 9. Проделаем реакцию между карбонатом калия и соляной кислотой.
- 10. Что мы наблюдаем ?
- 11. Запишем уравнение реакции. Проверим.
- 12. Молекулярное уравнение K2CO3 + 2HCl = 2KCl + H2O + CO2↑ Полный ионный вид 2K+ +
- 13. Правила составления ионных уравнений реакции Сильные электролиты записывают в виде образующих их ионов ( с учетом
- 14. Формулы слабых электролитов ( в т.ч. H2O ), нерастворимых и газообразных веществ записываются в молекулярной форме
- 15. Если вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз ( ↓
- 16. Проделаем реакцию между сульфатом меди(2) и гидроксидом натрия.
- 17. Что мы наблюдаем ?
- 18. Запишем уравнение реакции. Проверим.
- 19. Молекулярное уравнение: CuSO4 + 2NaOH = = Cu(OH)2↓ + Na2SO4 Полное ионное уравнение: Cu2+ + SO42-
- 20. Реакции ионного обмена в растворах электролитов практически осуществимы (протекают до конца) только в тех случаях, когда
- 21. Тестовый контроль № 1 Дополните. Частицы заряженные положительно называются ________________________________ Частицы заряженные отрицательно называются _____________________________
- 22. № 2 Продукты реакции нейтрализации 1. Соль и вода 2. Соль и основание 3. Соль и
- 23. № 3 Реакция ионного обмена, идущая до конца 1. MgSO4 + Ba(NO3)2 → 2. MgCl2 +
- 24. № 4 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие три равные группы их
- 25. № 5 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие две равные группы их
- 26. Ответы № 1 Частицы заряженные положительно называются Катионы Частицы заряженные отрицательно называются Анионы № 2 1.
- 27. № 3 1. MgSO4 + Ba(NO3)2 → № 4 1-я группа (схемы электролитической диссоциации щелочей) :
- 28. № 5 1-я группа (схемы электролитической диссоциации соединений натрия) : а) NaOH → Na+ + OH-
- 30. Скачать презентацию



























 Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Основания. Классификация оснований
Основания. Классификация оснований Карбонові кислоти
Карбонові кислоти Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Породообразующие минералы
Породообразующие минералы Классификация химических реакций
Классификация химических реакций Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Природні гази
Природні гази Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Фосфор и его соединения
Фосфор и его соединения Зелёная химия
Зелёная химия Алкены. Этилен
Алкены. Этилен Переработка угля
Переработка угля Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Штучні і синтетичні волокна
Штучні і синтетичні волокна Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Обобщение по типам химических реакций
Обобщение по типам химических реакций Щелочные металлы
Щелочные металлы Сульфиды. Занятие 7
Сульфиды. Занятие 7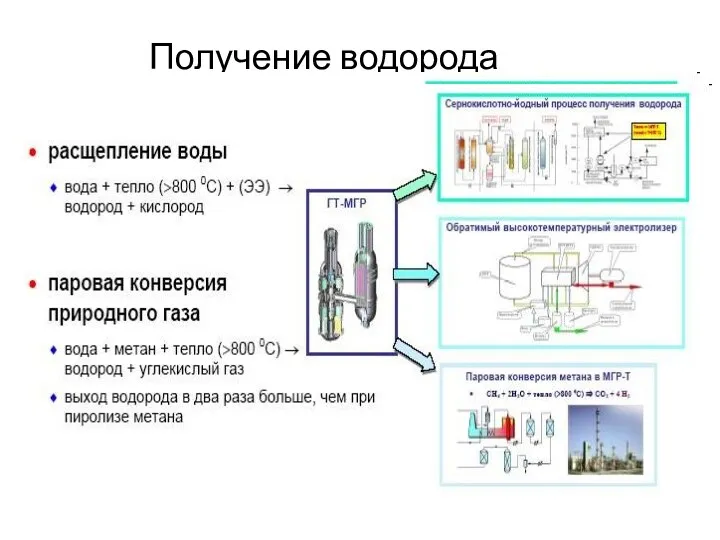 Получение водорода
Получение водорода Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1)
Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Производство низших олефинов
Производство низших олефинов Виды топлива
Виды топлива