Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 6. Горение серы в кислороде: Классификация химических реакций
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 8. Получение кислорода из перманганата калия: Классификация химических реакций
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
- 10. Взаимодействие натрия с водой: Классификация химических реакций
- 11. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 12. Получение аммиака из нашатыря Классификация химических реакций
- 13. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 14. Взаимодействие железа с медным купоросом: Классификация химических реакций
- 15. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 16. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 17. Разложение пероксида водорода: Классификация химических реакций
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
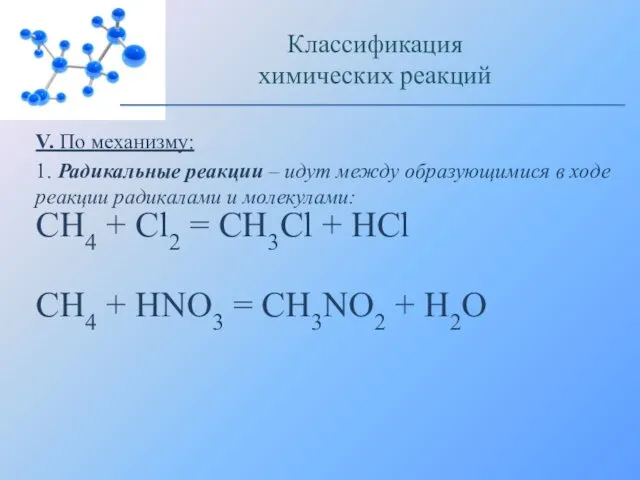
- 19. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 20. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 21. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
- 22. Горение фосфора в кислороде: Классификация химических реакций
- 23. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 24. Разложение оксида ртути: Классификация химических реакций
- 25. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой
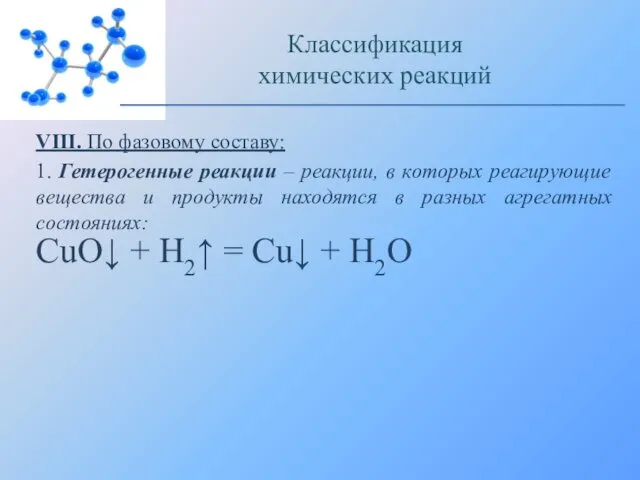
- 26. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 27. Восстановление оксида меди (II) водородом: Классификация химических реакций
- 29. Скачать презентацию
























 Польза и вред химического производства
Польза и вред химического производства Серная кислота. Занимательные опыты
Серная кислота. Занимательные опыты Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Хімічні явища в побуті
Хімічні явища в побуті Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Альдегиды и кетоны
Альдегиды и кетоны Полипропилен
Полипропилен Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Химия p-элементов
Химия p-элементов Энергоресурсы и их использование
Энергоресурсы и их использование Основные понятия и законы химии
Основные понятия и законы химии Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химические волокна (7 класс)
Химические волокна (7 класс) Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Качественные реакции на органические вещества
Качественные реакции на органические вещества Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот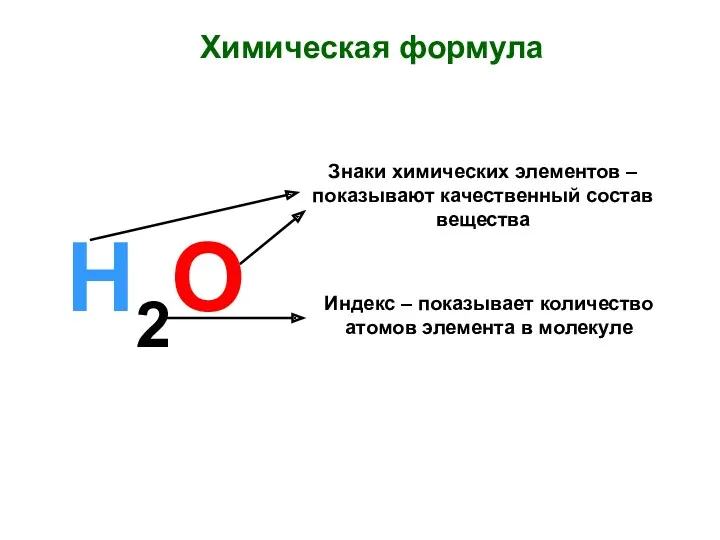 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Азот
Азот Глицерин. Основные способы получения
Глицерин. Основные способы получения Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Такой разный песок
Такой разный песок Каучук. Открытие каучука
Каучук. Открытие каучука Щелочные металлы
Щелочные металлы Кристаллохимия как наука
Кристаллохимия как наука Каталитический риформинг бензинов
Каталитический риформинг бензинов Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Концентрация кобальта
Концентрация кобальта