Содержание
- 2. Задание 1 Дайте характеристику Rb и Сs по его положению в Периодической системе по плану: а)положение
- 3. Щелочные металлы. Химические свойства. Важнейшие соединения щелочных металлов.
- 4. Щелочные металлы - хорошие восстановители Взаимодействуют с окислителями: Неметаллами Водой Кислотами
- 5. Взаимодействие с простыми веществами-неметаллами С кислородом Li + O2 → Li2O оксид лития Na + O2
- 6. С галогенами 2Li + Cl2 → 2LiCl Хлорид лития 2Na + Cl2 → 2NaCl Хлорид натрия
- 7. Взаимодействие со сложными веществами С водой 2Li + 2H2O → 2LiOH +H2 Гидроксид лития 2Na +2H2O
- 8. Важнейшие соединения щелочных металлов Оксиды Me2O - твердые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с
- 9. KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Гидроксиды щелочных металлов Какова
- 10. Соли щелочных металлов – твердые кристаллические вещества ионного строения. NaCl – каменная соль Na2CO3 – карбонат
- 12. Способы получения Электролиз расплава МеСl эл.ток Ме+ + Сl- на катоде: Ме+ + 1е Ме0 на
- 13. О каком элементе идет речь? Хранят обычно в керосине, и бегает он по воде, В природе,
- 14. Задание 2: Запишите уравнения реакций взаимодействия калия с кислородом, с бромом, с фосфором, с водой. Напишите
- 15. 1.Что нового вы сегодня узнали на уроке, чему научились? 2.Что еще хотели бы узнать, изучить? 3.Что
- 17. Скачать презентацию














 Неметаллы
Неметаллы Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Витамины. Аскорбиновая кислота
Витамины. Аскорбиновая кислота Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Азотная кислота
Азотная кислота Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах
Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах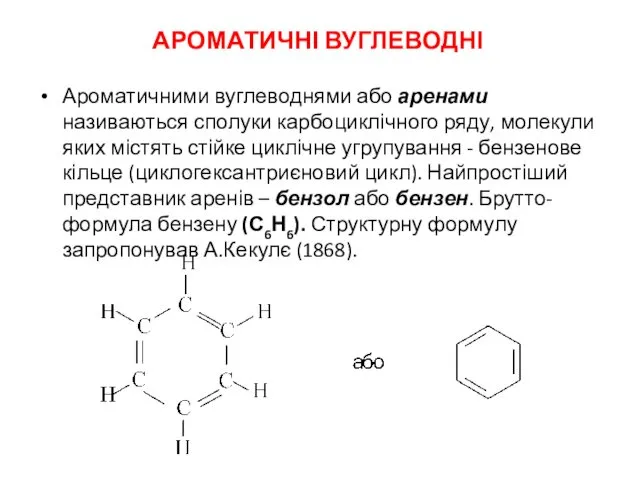 Ароматичні вуглеводні
Ароматичні вуглеводні Кристалы и их свойства
Кристалы и их свойства Химическая взрывчатка
Химическая взрывчатка Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Атомы химических элементов. Электроотрицательность атомов химических элементов
Атомы химических элементов. Электроотрицательность атомов химических элементов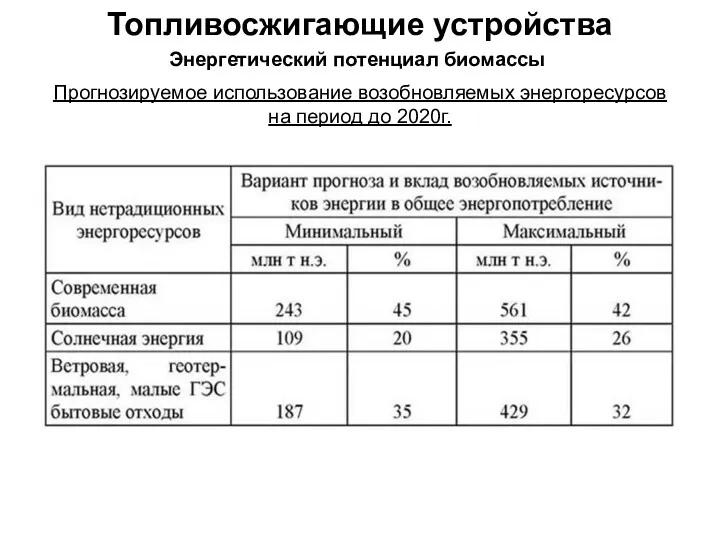 Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Electron configuration and periodicity
Electron configuration and periodicity Правила по технике безопасности в химической лаборатории
Правила по технике безопасности в химической лаборатории Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод Reactors for catalytic alkylation
Reactors for catalytic alkylation Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Яды и химикаты
Яды и химикаты Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Каучук. Получение натурального каучука
Каучук. Получение натурального каучука Химическое равновесие
Химическое равновесие Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Карбонові кислоти
Карбонові кислоти Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия Ядерное топливо
Ядерное топливо Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Непредельные углеводороды. Алкены (этиленовые углеводороды)
Непредельные углеводороды. Алкены (этиленовые углеводороды)