Содержание
- 2. По - античному наивно, Откровенно простовато Совершенно "неделимым" Называли греки атом. Но теперь твердит наука: Атом
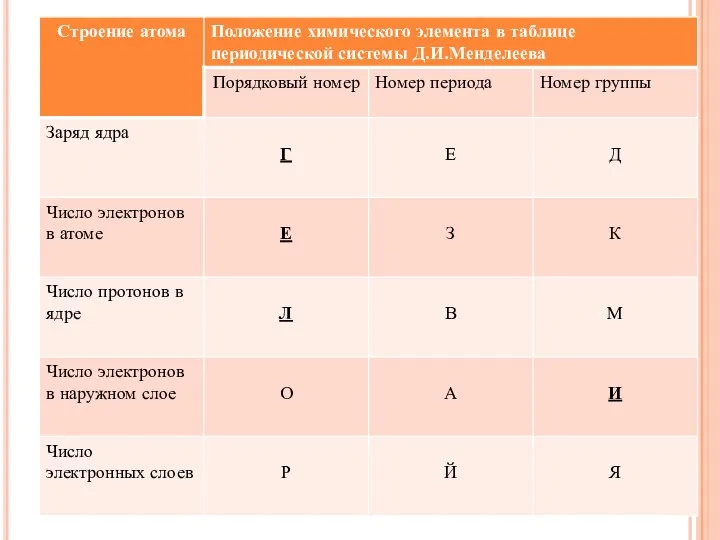
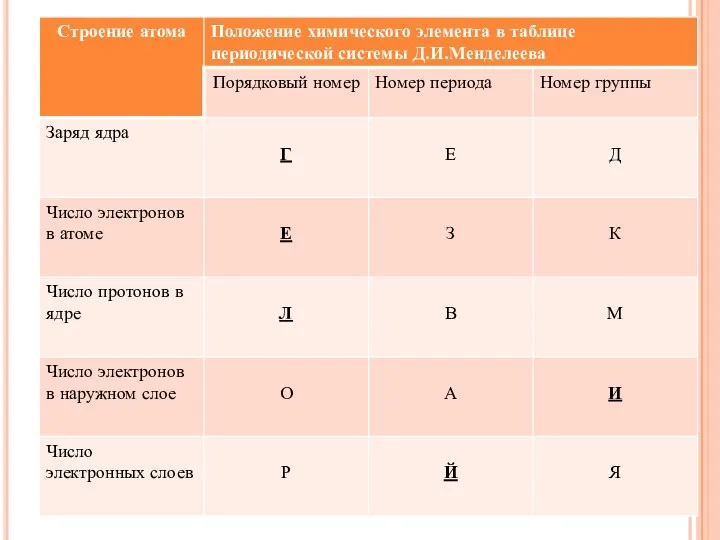
- 3. Назовите химический элемент, укажите его порядковый номер , относительную атомную массу, укажите его местоположение в Периодической
- 4. Атом химического элемента заряжен: 1– положительно; 2. – отрицательно; 3. – заряда не имеет. Ядро атома
- 5. Электроотрицательность атомов химических элементов в соединениях в пределах одного периода с увеличением порядкового номера элемента: 1-возрастает;
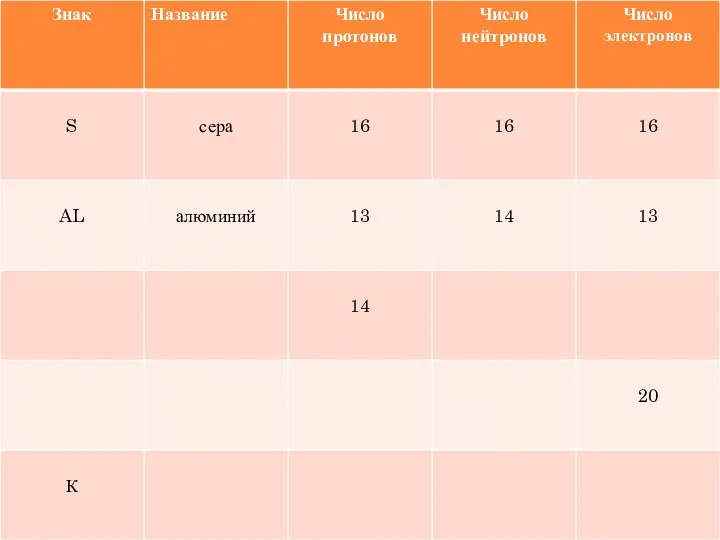
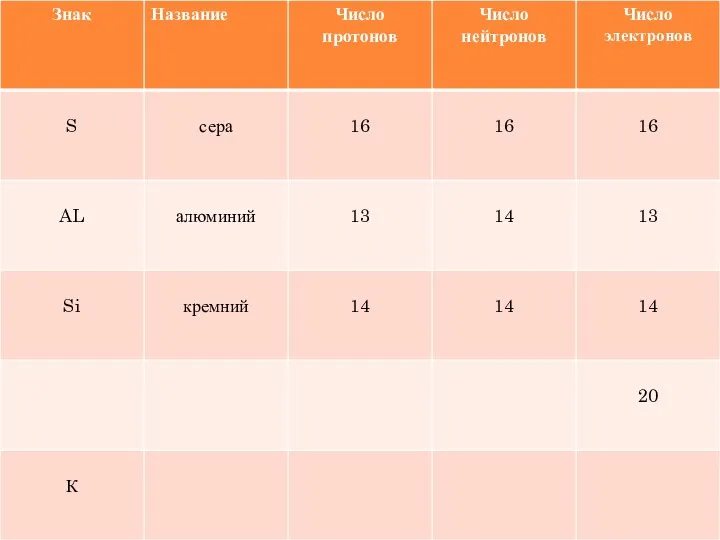
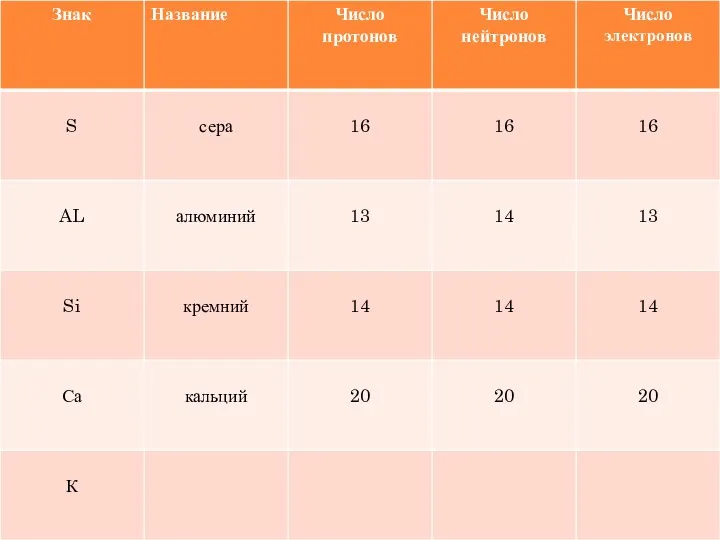
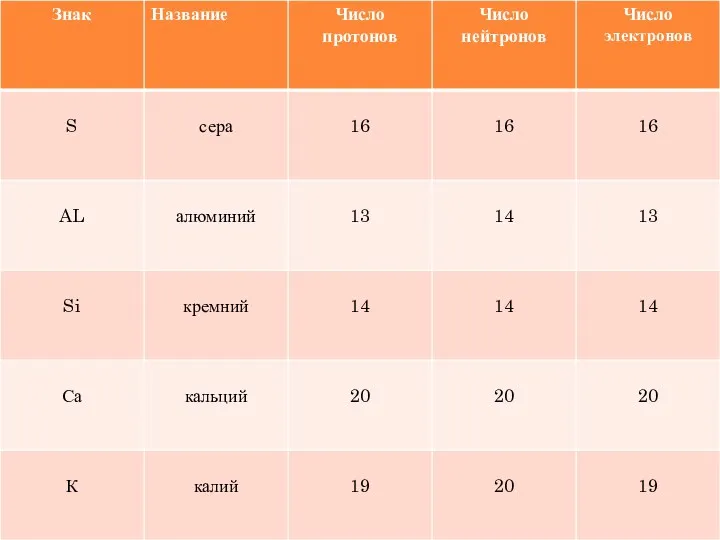
- 18. УГАДАЙТЕ ХИМИЧЕСКИЙ ЭЛЕМЕНТ
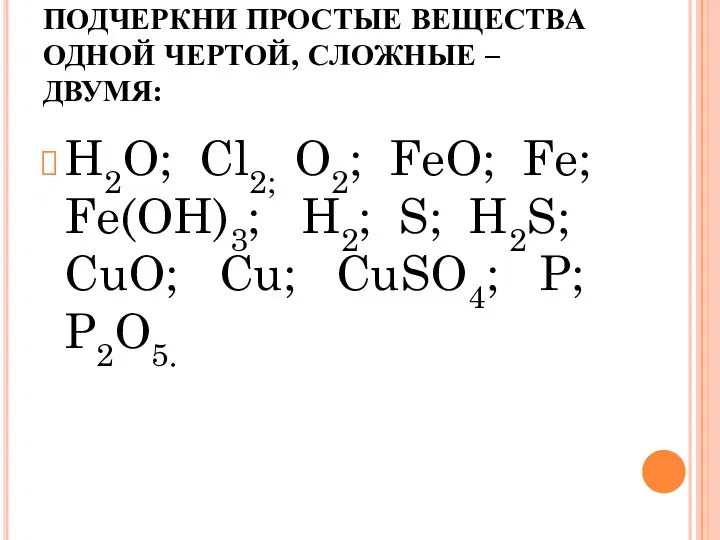
- 19. ПОДЧЕРКНИ ПРОСТЫЕ ВЕЩЕСТВА ОДНОЙ ЧЕРТОЙ, СЛОЖНЫЕ – ДВУМЯ: H2O; Cl2; O2; FeO; Fe; Fe(OH)3; H2; S;
- 22. ИЗ ФОРМУЛ: Al; Al(OH)3 ; AlCL3; Al2O3; H2; H2O; H2S, Na2S ; SO2; S; H2SO4; Cu;
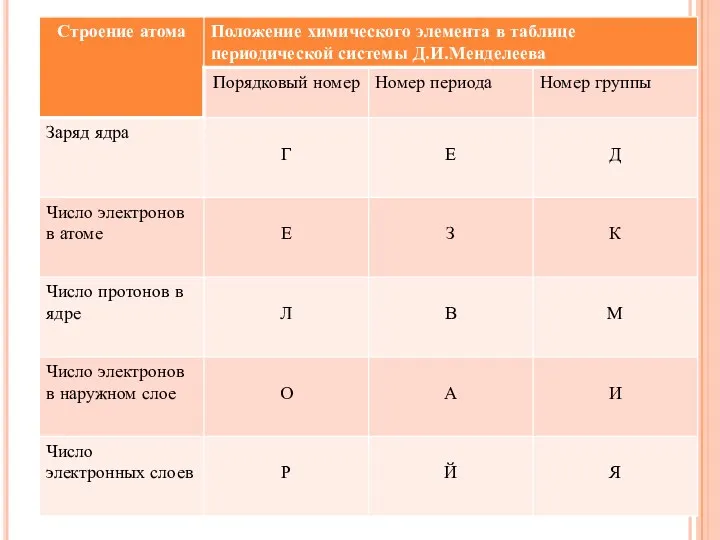
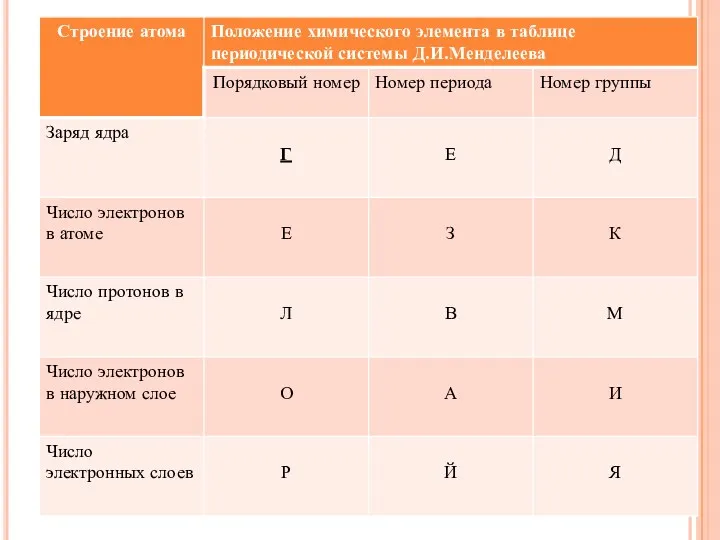
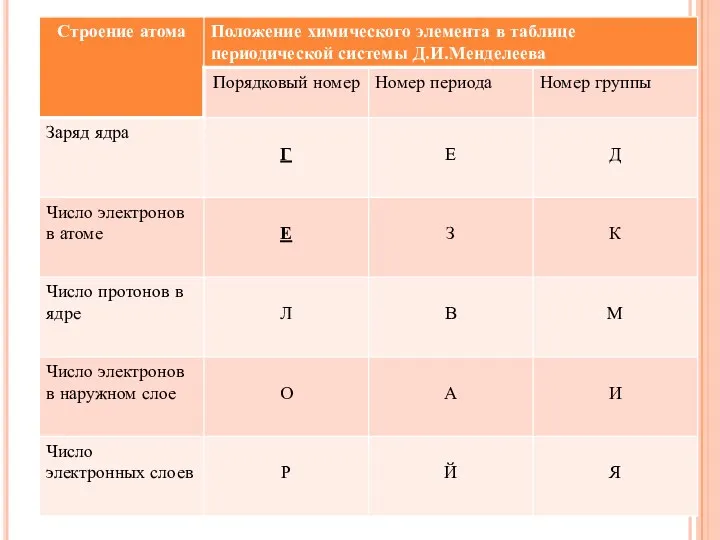
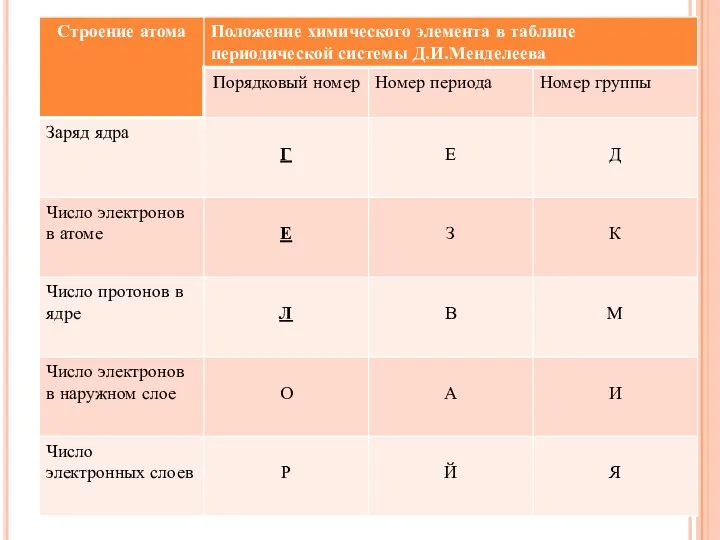
- 23. ЗАПОЛНИТЕ ПРОПУСКИ В ТЕКСТЕ «СТРОЕНИЕ АТОМА». Строение атома 1. Атом состоит из двух основных частей: __________
- 24. Строение атома 1. Атом состоит из двух основных частей: ядра и электронной оболочки. 2. В центре
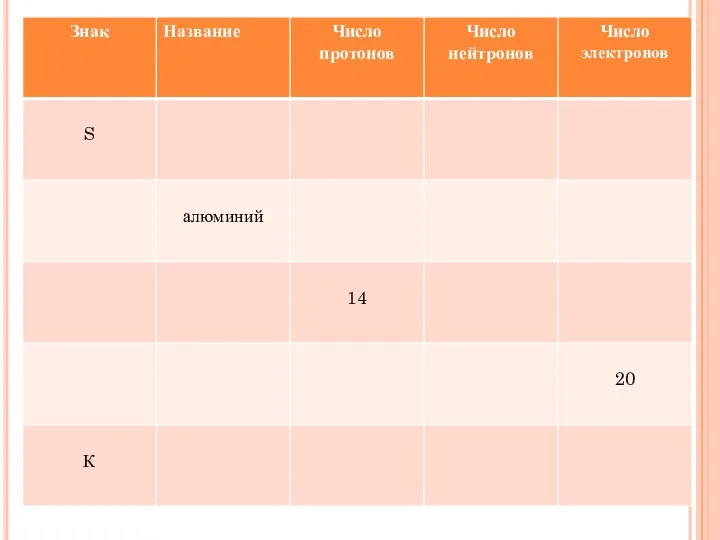
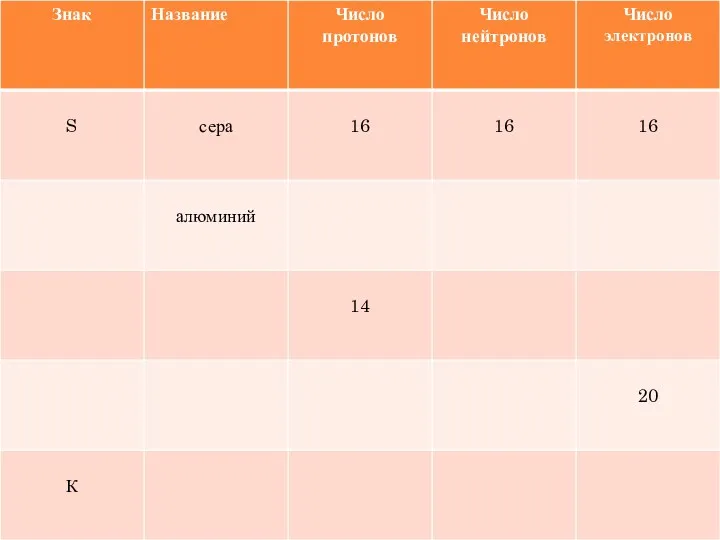
- 25. РЕШИТЕ ЗАДАЧКУ: Вычислите относительную молекулярную массу оксида кремния- SiO2 и массовые доли элементов в молекуле этого
- 27. «ДА - НЕТ» Металлическая связь образуется в металлах ? Число неспаренных электронов в атоме определяют путём
- 29. Скачать презентацию











 Стронций
Стронций Электролитическая диссоциация. Гидролиз
Электролитическая диссоциация. Гидролиз Сполуки фосфору
Сполуки фосфору Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів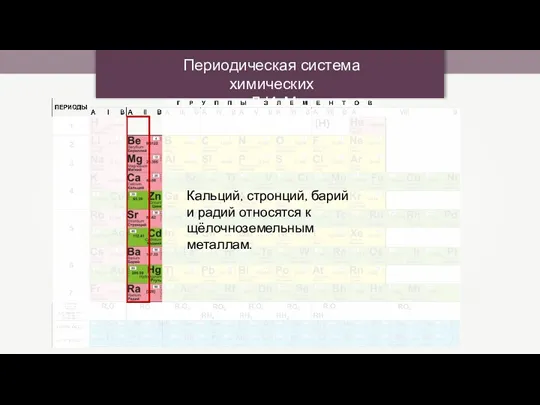 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Строение атома. Теории строения атома
Строение атома. Теории строения атома Алюминий на кухне - опасный враг или верный помощник
Алюминий на кухне - опасный враг или верный помощник Диагностические свойства минералов
Диагностические свойства минералов Физические свойства минералов
Физические свойства минералов Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Азотная кислота
Азотная кислота Таланты известных химиков
Таланты известных химиков Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Химия - тұрмыста
Химия - тұрмыста Валентность и степень окисления атомов в молекуле
Валентность и степень окисления атомов в молекуле Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Ионная химическая связь
Ионная химическая связь Подгруппа углерода
Подгруппа углерода Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов
Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Вещества в твоей жизни
Вещества в твоей жизни Растворы ВМС и их свойства
Растворы ВМС и их свойства Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Жесткость воды
Жесткость воды Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов