Содержание
- 2. Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной
- 3. ИЗ ИСТОРИИ Азотная кислота — коррозионно активное, токсическое вещество и сильный окислитель. Со средних веков известно
- 4. CВОЙСТВА Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе
- 5. ПОЛУЧЕНИЕ Азотная кислота в промышленных масштабах получается тремя основными способами: Первый — взаимодействием солей с серной
- 7. Скачать презентацию
Слайд 2
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует
две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Слайд 3
ИЗ ИСТОРИИ
Азотная кислота — коррозионно активное, токсическое вещество и сильный окислитель.
ИЗ ИСТОРИИ
Азотная кислота — коррозионно активное, токсическое вещество и сильный окислитель.
Со средних веков известно такое название, как «сильная вода» (Aqua fortis). Алхимики, открывшие кислоту в 13 веке, дали такое название, убедившись в ее необычайных свойствах (разъедала все металлы, кроме золота), превосходящих в миллион раз силу уксусной кислоты, которую в те времена считали самой активной. Но еще через три столетия было установлено, что разъедать, даже золото, может смесь таких кислот, как азотная и соляная в объемном соотношении 1:3, которую по этой причине и назвали «царская водка». Появление желтого оттенка при хранении объясняется накоплением в ней окислов азота. В продаже кислота чаще бывает с концентрацией 68 %, а при содержании основного вещества более 89 % ее называют «дымящей».
Слайд 4
CВОЙСТВА
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота —
CВОЙСТВА
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота —
бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь. Имеет молярную массу 63,0 г/моль, а ее плотность соответствует 1,51 г/см³.
Слайд 5
ПОЛУЧЕНИЕ
Азотная кислота в промышленных масштабах получается тремя основными способами:
Первый — взаимодействием
ПОЛУЧЕНИЕ
Азотная кислота в промышленных масштабах получается тремя основными способами:
Первый — взаимодействием
солей с серной кислотой: H2SO4 + NaNO3 → HNO3 + NaHSO4. Раньше это способ был единственным, но, с появлением других технологий, в настоящее время его используют в лабораторных условиях для получения дымящей кислоты.
Второй — это дуговой способ. При продувании воздуха через электрическую дугу с температурой от 3000 до 3500 оС, часть азота воздуха реагирует с кислородом, при этом образуется монооксид азота: N2 + O2 → 2NO, который после охлаждения окисляется до диоксида азота (при высокой температуре монооксид с кислородом не взаимодействует): O2 + 2NO → 2NO2. Затем, практически, весь диоксид азота, при избытке кислорода, растворяется в воде: 2H2O +4NO2 + O2 → 4HNO3.
Третий — это аммиачный способ. Аммиак окисляется на платиновом катализаторе до монооксида азота: 4NH3 + 5O2 → 4NO + 6H2O. Образовавшиеся нитрозные газы охлаждаются, и образуется диоксид азота, который поглощается водой. Этим способом получают кислоту с концентрацией от 60 до 62 %.
Второй — это дуговой способ. При продувании воздуха через электрическую дугу с температурой от 3000 до 3500 оС, часть азота воздуха реагирует с кислородом, при этом образуется монооксид азота: N2 + O2 → 2NO, который после охлаждения окисляется до диоксида азота (при высокой температуре монооксид с кислородом не взаимодействует): O2 + 2NO → 2NO2. Затем, практически, весь диоксид азота, при избытке кислорода, растворяется в воде: 2H2O +4NO2 + O2 → 4HNO3.
Третий — это аммиачный способ. Аммиак окисляется на платиновом катализаторе до монооксида азота: 4NH3 + 5O2 → 4NO + 6H2O. Образовавшиеся нитрозные газы охлаждаются, и образуется диоксид азота, который поглощается водой. Этим способом получают кислоту с концентрацией от 60 до 62 %.
- Предыдущая
Политико-правовая доктрина Н. М. КоркуноваСледующая -
Лесные ресурсы планеты



 Медь и её сплавы
Медь и её сплавы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Урок 25
Урок 25 Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Классификация органических веществ
Классификация органических веществ Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Кислород как элемент
Кислород как элемент Реакции ионного обмена
Реакции ионного обмена Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Ароматические соединения - арены
Ароматические соединения - арены Органическая химия
Органическая химия Теоретические основы органической химии
Теоретические основы органической химии Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Электролитическая диссоциация
Электролитическая диссоциация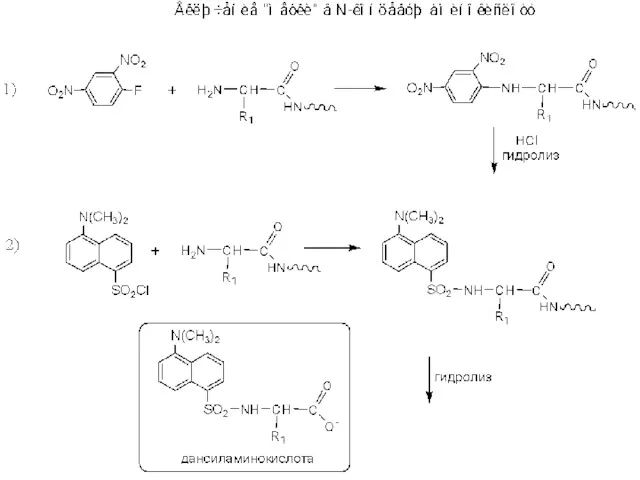 Установление структуры биополимеров
Установление структуры биополимеров Гидролиз. Классификация солей
Гидролиз. Классификация солей Коллоидная химия
Коллоидная химия Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Итоговая контрольная работа по химии
Итоговая контрольная работа по химии Мило. Мийні засоби
Мило. Мийні засоби Свойства минеральных удобрений
Свойства минеральных удобрений Мыльная история. (3 класс)
Мыльная история. (3 класс) Неорганические соединения. Основания
Неорганические соединения. Основания kremniy
kremniy Камни и минералы
Камни и минералы Сложные эфиры. Жиры
Сложные эфиры. Жиры Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени