Содержание
- 2. Признаки объектов коллоидной химии
- 3. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц
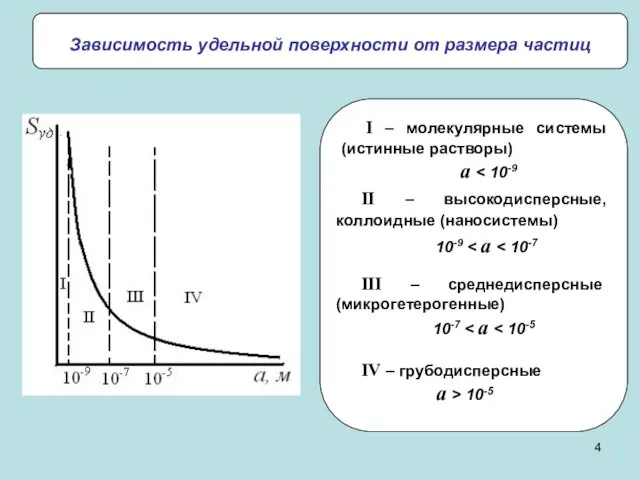
- 4. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
- 5. Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность
- 6. Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
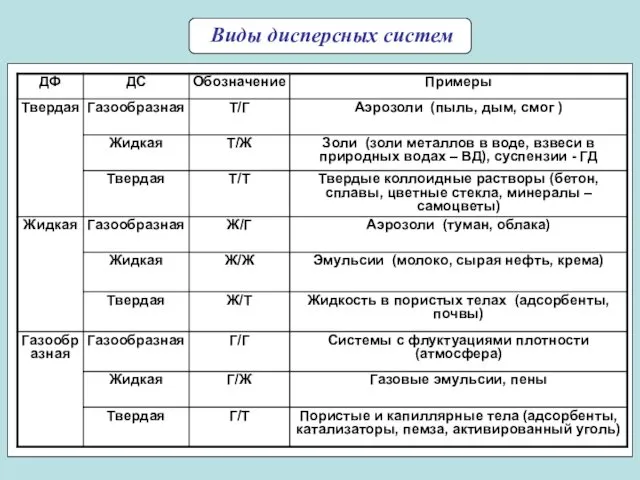
- 7. Виды дисперсных систем
- 8. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 9. Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 %
- 10. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 11. Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).
- 12. Физические конденсационные методы
- 13. Химические конденсационные методы
- 15. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 16. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 17. Метод пептизации
- 18. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 19. Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света,
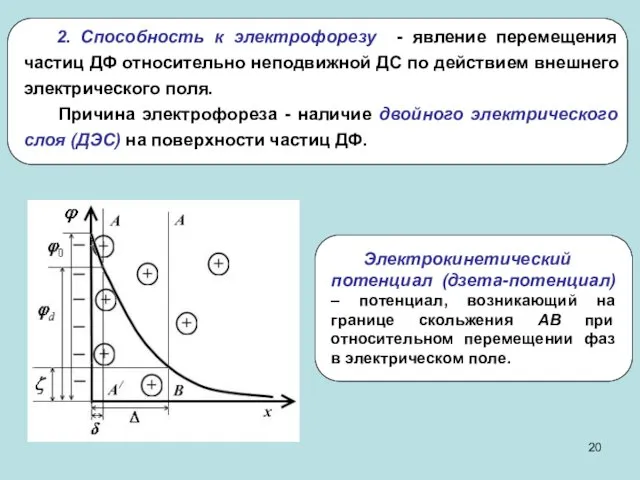
- 20. 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического
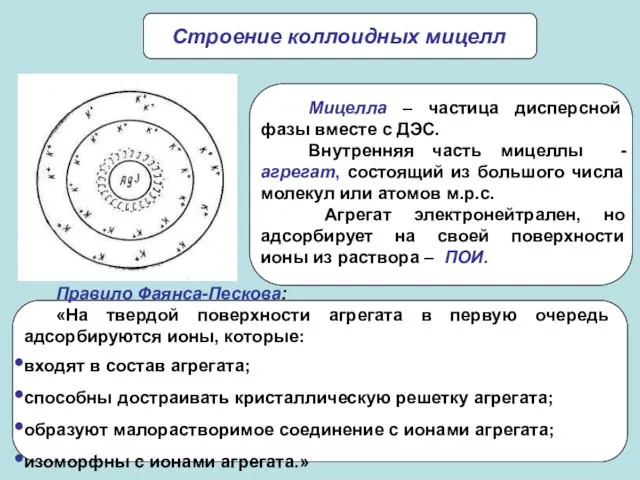
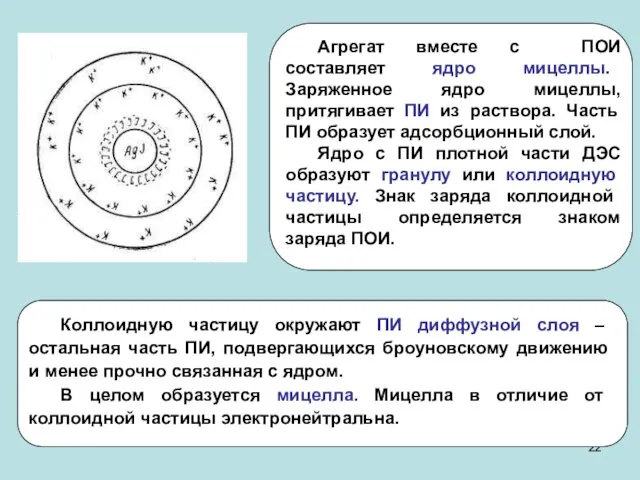
- 21. Строение коллоидных мицелл
- 23. Пример 1:
- 24. Устойчивость и коагуляция дисперсных систем
- 25. Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию
- 26. Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая
- 28. Скачать презентацию




















 Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Гетерофункциональные соединения
Гетерофункциональные соединения Циклоалканы
Циклоалканы Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Введение в геологию и минералогию
Введение в геологию и минералогию Электрохимические системы
Электрохимические системы Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Нефть
Нефть Классификация химических реакций
Классификация химических реакций Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Вещества в твоей жизни
Вещества в твоей жизни Біохімія вуглеводів
Біохімія вуглеводів Оксиды. 9 класс
Оксиды. 9 класс Вуглеводи
Вуглеводи Нефть как природный источник углеводородов
Нефть как природный источник углеводородов Признаки химических реакций
Признаки химических реакций Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі Химический элемент водород
Химический элемент водород Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химико-лесной комплекс
Химико-лесной комплекс