Содержание
- 2. Общие понятия электрохимии. Проводники первого и второго рода Электрохимия – это раздел химии, занимающийся изучением закономерностей
- 3. Изоляторы, полупроводники и проводники По электрической проводимости, все вещества можно разделить на три группы: изоляторы, полупроводники
- 4. Гальваническим элементом называют электрохимическую систему, в которой за счет протекания химических процессов совершается электрическая работа. Гальванический
- 5. Полуэлемент – это металл, погруженный в раствор своей хорошо растворимой соли, а металл называют электродом (иногда
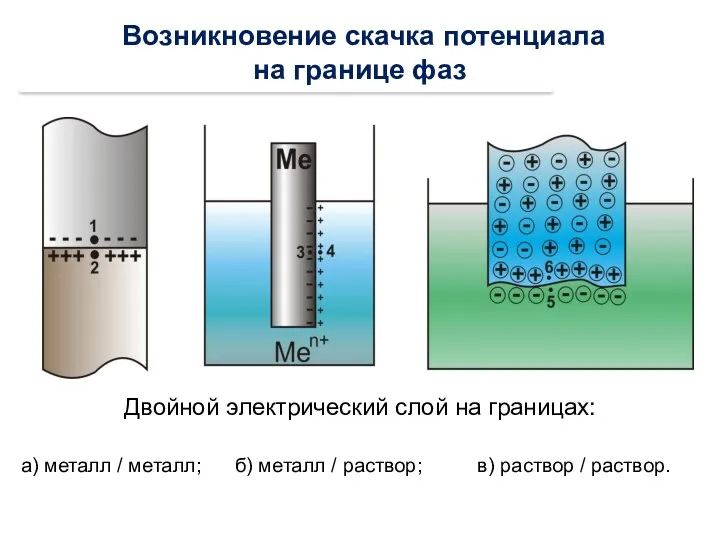
- 6. Возникновение скачка потенциала на границе фаз Двойной электрический слой на границах: а) металл / металл; б)
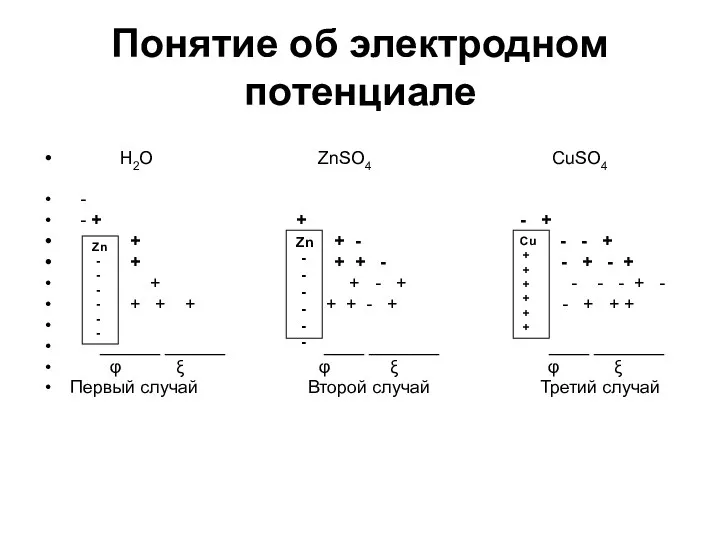
- 7. Понятие об электродном потенциале H2O ZnSO4 CuSO4 - - + + - + + + -
- 8. Первый случай Ионы металлического цинка, входящие в кристаллическую решетку под действием диполя воды отрываются и переходят
- 9. Второй случай. Аналогичный процесс будет протекать при погружении цинковой пластины в раствор соли цинка - ZnSO4.
- 10. Третий случай. При погружении химически неактивного металла например меди, в раствор соли CuSO4 будет протекать процесс
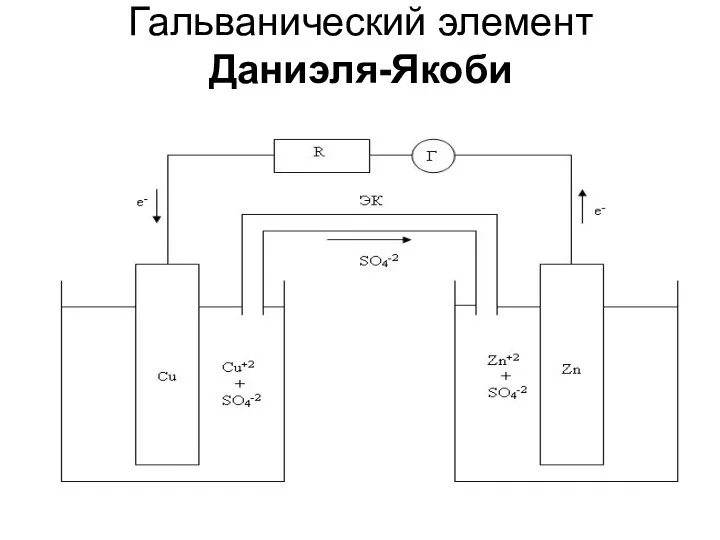
- 11. Гальванический элемент Даниэля-Якоби
- 12. Таким образом, при замыкании цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделение меди
- 13. Электродвижущая сила гальванического элемента Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента,
- 14. При обратимом протекании химической реакции в гальваническом элементе в условиях постоянства температуры и давления получаемая электрическая
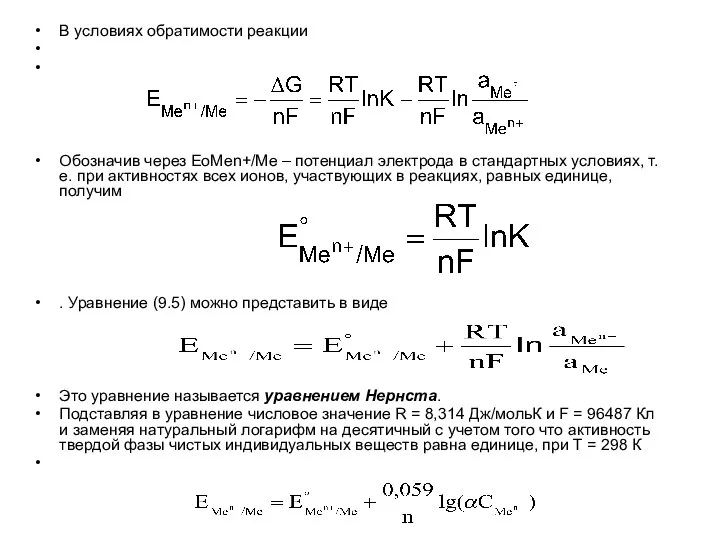
- 15. В условиях обратимости реакции Обозначив через EoMen+/Me – потенциал электрода в стандартных условиях, т.е. при активностях
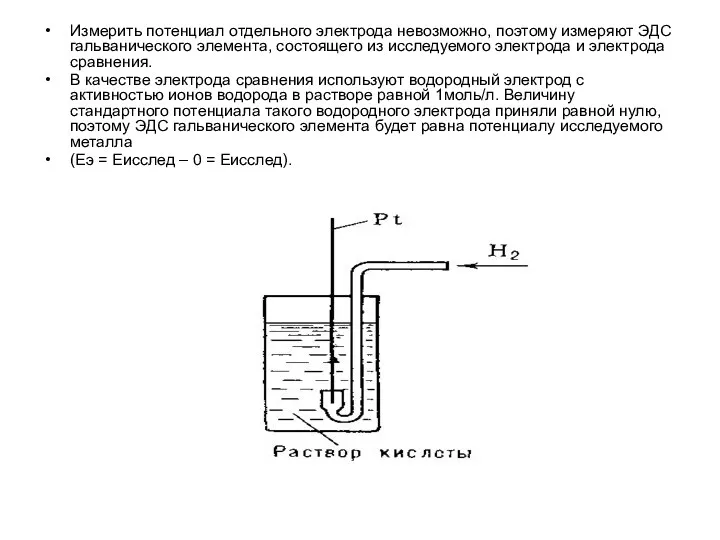
- 16. Измерить потенциал отдельного электрода невозможно, поэтому измеряют ЭДС гальванического элемента, состоящего из исследуемого электрода и электрода
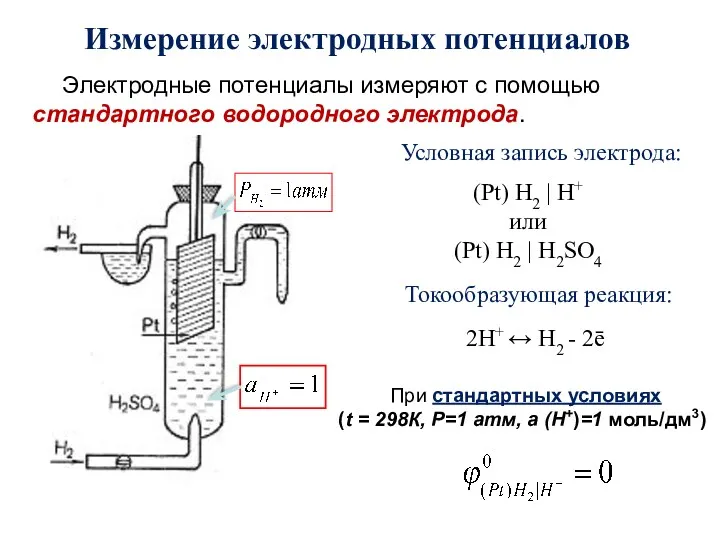
- 17. Измерение электродных потенциалов Электродные потенциалы измеряют с помощью стандартного водородного электрода. При стандартных условиях (t =
- 18. Уравнение Нернста для водородного электрода:
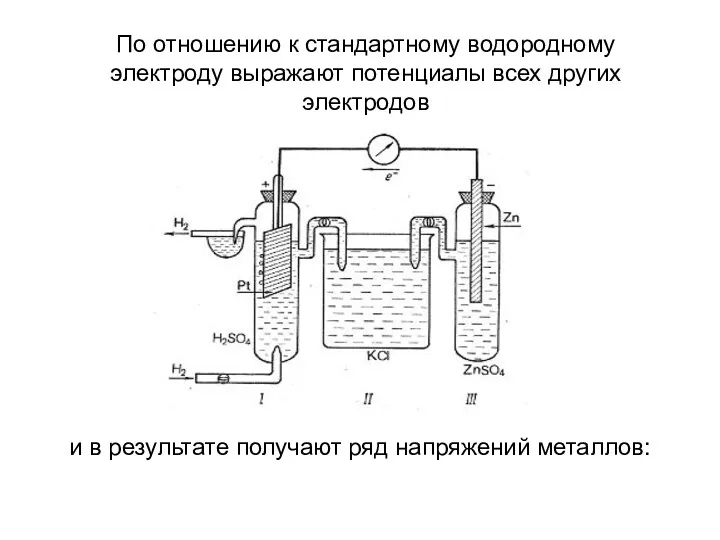
- 19. По отношению к стандартному водородному электроду выражают потенциалы всех других электродов и в результате получают ряд
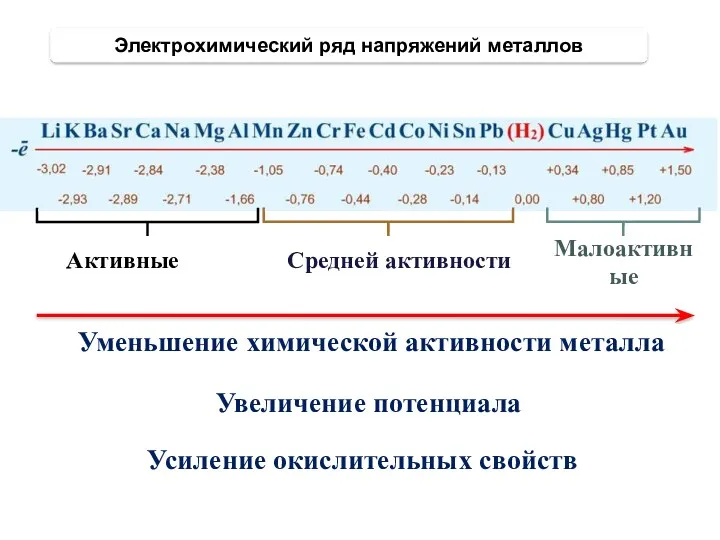
- 20. Электрохимический ряд напряжений металлов Увеличение потенциала Усиление окислительных свойств Уменьшение химической активности металла Активные Средней активности
- 21. Стандартные потенциалы различных металлов, измеренные по отношению к водородному электроду, расположены в порядке возрастания, образуя ряд
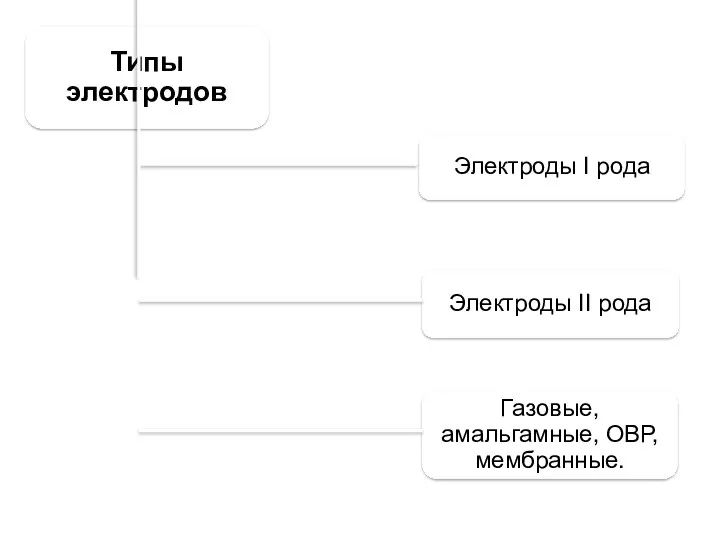
- 22. Типы электродов Электроды I рода Электроды II рода Газовые, амальгамные, ОВР, мембранные.
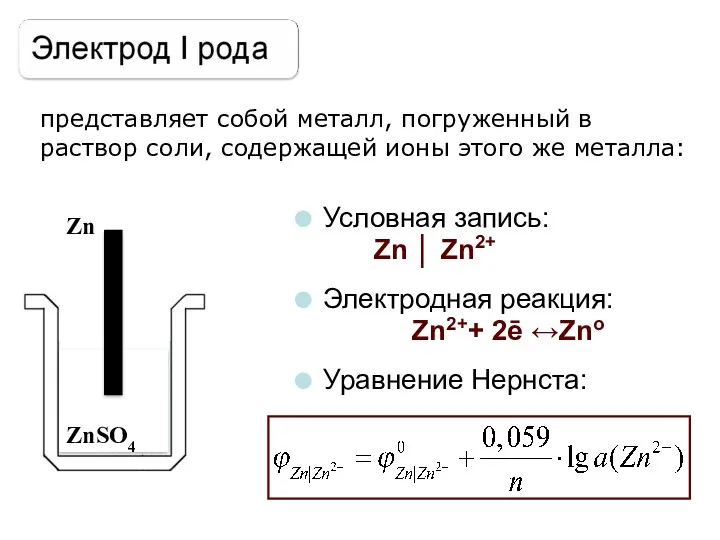
- 23. представляет собой металл, погруженный в раствор соли, содержащей ионы этого же металла: Zn ZnSO4 Условная запись:
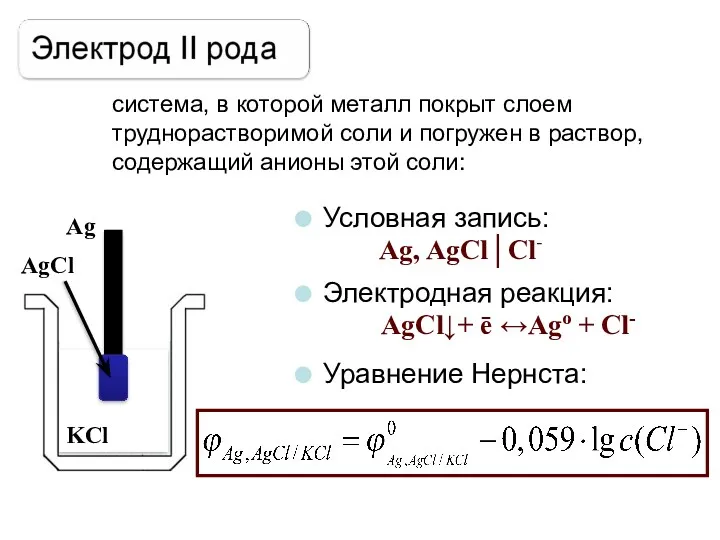
- 24. система, в которой металл покрыт слоем труднорастворимой соли и погружен в раствор, содержащий анионы этой соли:
- 25. Хлорсеребряный электрод - электрод сравнения В насыщенном растворе KCl при температуре 25оС потенциал хлорсеребряного электрода φ
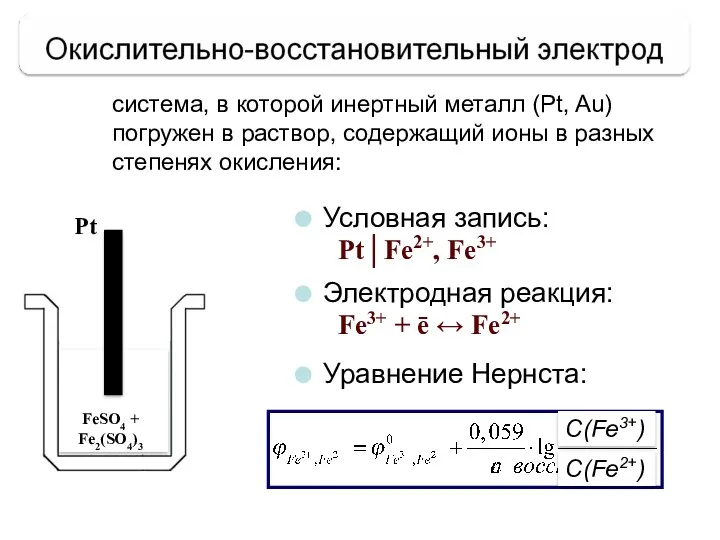
- 26. система, в которой инертный металл (Pt, Au) погружен в раствор, содержащий ионы в разных степенях окисления:
- 27. Поляризация и перенапряжение При самопроизвольных процессах устанавливается равновесный потенциал электродов. При прохождении электрического тока потенциал электродов
- 28. Электролиз. Законы Фарадея Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего
- 29. Второй закон Фарадея Массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим
- 30. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (η, %): η =
- 31. Электролиз расплава Хлорида натрия приводит к восстановлению ионов Na+ до металлического натрия на катоде (отрицательном электроде)
- 32. Электролиз раствора. При наличии нескольких видов ионов или молекул веществ возможно протекание нескольких электродных реакций. На
- 33. Анодный процесс На аноде в первую очередь реагируют наиболее сильные восстановители – вещества, имеющие наиболее отрицательные
- 34. На растворимом аноде идет процесс растворения самого анода, например, Сu - 2e → Cu2+
- 35. Применение Электролиз применяют в: 1) металлургии для получения меди, цинка, кобальта, марганца и других металлов; 2)
- 36. Коррозия металлов Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. По
- 37. Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При этом происходит анодное растворение металла и катодное
- 38. Методы защиты металлов от коррозии легирование металлов – введение легирующих добавок при плавлении (Mo, W, Gr,
- 39. Аккумуляторы Аккумуляторами называются называются гальванические элементы, предназначенные для многократного использования. При заряде аккумулятора реагенты регенерируют в
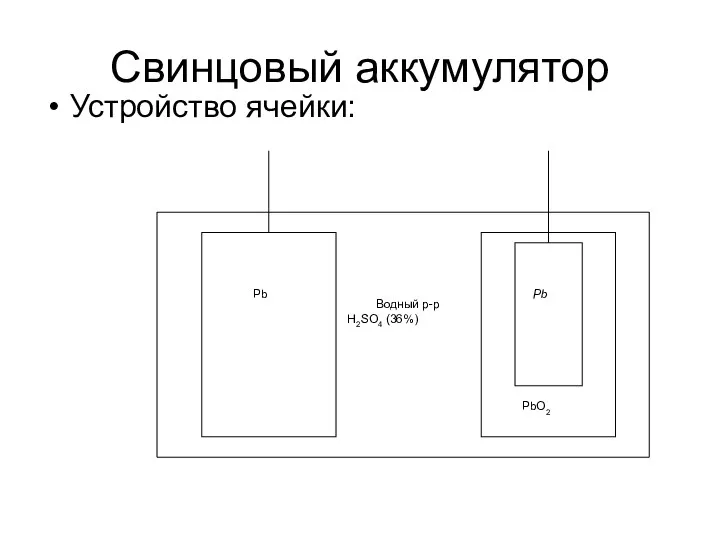
- 40. Свинцовый аккумулятор Устройство ячейки:
- 41. При работе свинцового аккумулятора (разряде) на электродах идут процессы: анод (-) Pb + SO4-2 + 2e-=
- 43. Скачать презентацию



























 Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обмоточные провода
Обмоточные провода Химический элемент титан
Химический элемент титан Металлы
Металлы Хімія елементів VIIВ групи (Mn, Tc, Re)
Хімія елементів VIIВ групи (Mn, Tc, Re) Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов Строение вещества. Строение атома
Строение вещества. Строение атома Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Элементарные частицы вещества
Элементарные частицы вещества Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Волокна. Классификация волокон
Волокна. Классификация волокон Химический состав клетки
Химический состав клетки Химические свойства органических веществ
Химические свойства органических веществ Хлор. Состав. Строение
Хлор. Состав. Строение Багатоядерні ароматичні сполуки
Багатоядерні ароматичні сполуки Металлы. Общие свойства и получение
Металлы. Общие свойства и получение Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Минеральные вещества
Минеральные вещества Күйдіргіш натрий
Күйдіргіш натрий Кристаллизация
Кристаллизация Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу
Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу Introduction to Biochemistry
Introduction to Biochemistry Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen Щелочные металлы
Щелочные металлы Химические свойства спиртов
Химические свойства спиртов Производные пирролидина, пиразолона и пиразолидиндиона: их свойства, анализ, хранение, применение
Производные пирролидина, пиразолона и пиразолидиндиона: их свойства, анализ, хранение, применение