Общие химические свойства металлов
Сильные восстановители
С простыми веществами
С кислородом (оксиды, пероксиды, надпероксиды)
С
галогенами (фториды, хлориды, бромиды, иодиды)
С азотом (нитриды)
С фосфором (фосфиды)
С водородом (гидриды)
Со сложными веществами
С кислотами:
МЕ + кислота = соль + водород
(не брать азотную и серную кислоты, металлы после водорода в ряду напряжений металлов)
2. С водой
а) активные металлы – гидроксиды и водород
б) металлы средней активности – оксиды и водород (при нагревании)
в) неактивные металлы – не реагируют
3. С солями – более активный металл вытесняет менее активный из его соли





 История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Основные химические понятия и законы
Основные химические понятия и законы Энергетика химических реакций.(Лекция 8,9)
Энергетика химических реакций.(Лекция 8,9)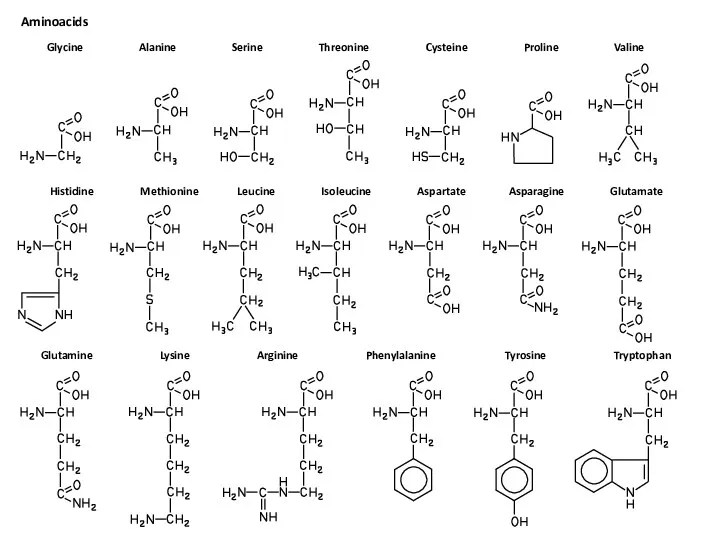 Немного формул. Aminoacids
Немного формул. Aminoacids Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю 20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii
20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Щелочноземельные металлы
Щелочноземельные металлы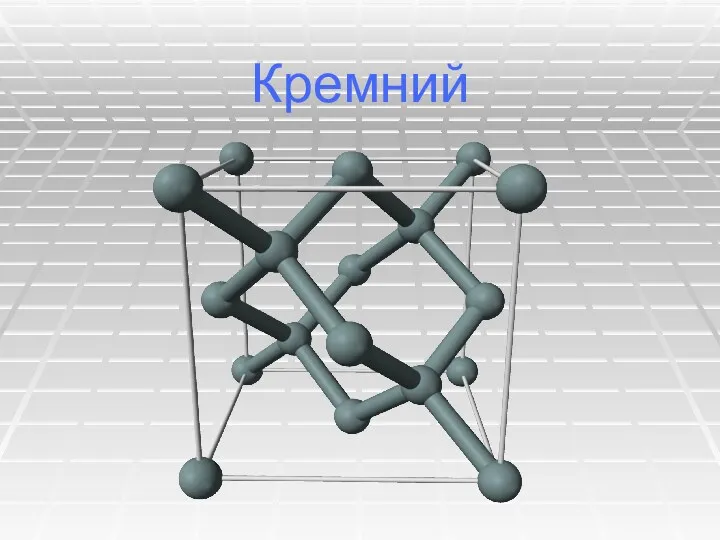 Кремний. Физические свойства кремния
Кремний. Физические свойства кремния Спирты. Классификация
Спирты. Классификация Методика изучения современной теории строения органических веществ
Методика изучения современной теории строения органических веществ Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы
Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Бутадиеновые каучуки
Бутадиеновые каучуки Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Кислоты: названия, получение, свойства, применение
Кислоты: названия, получение, свойства, применение Оксиды в минералогии
Оксиды в минералогии Аналитическая химия. Физико-химические методы анализа
Аналитическая химия. Физико-химические методы анализа Химические превращения веществ
Химические превращения веществ Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Международный Год периодической таблицы химических элементов
Международный Год периодической таблицы химических элементов Anionic Polymerization
Anionic Polymerization Щелочи
Щелочи Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс