Содержание
- 2. Спирты Спиртами называются производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные группы.
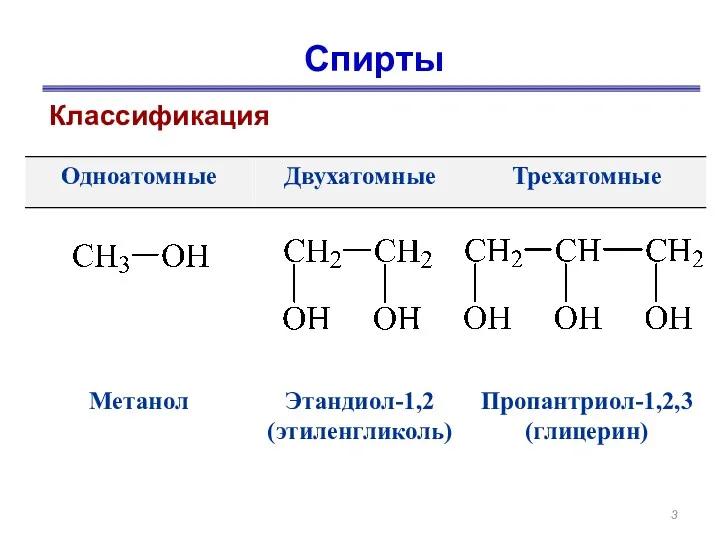
- 3. Спирты Классификация
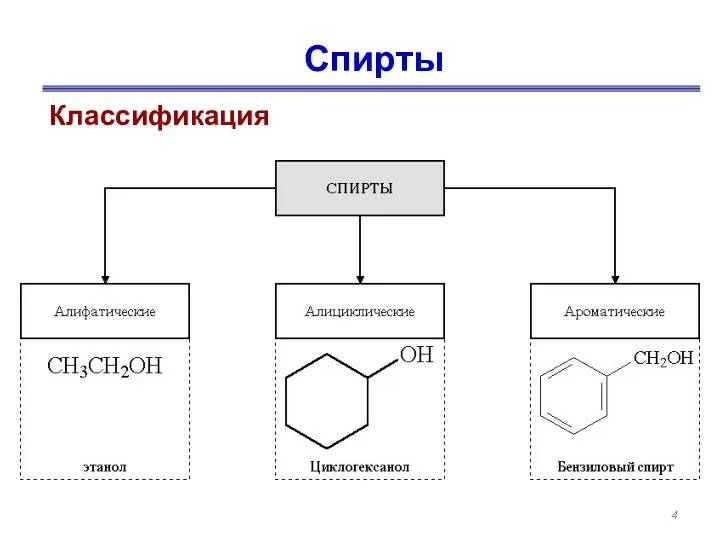
- 4. Спирты Классификация
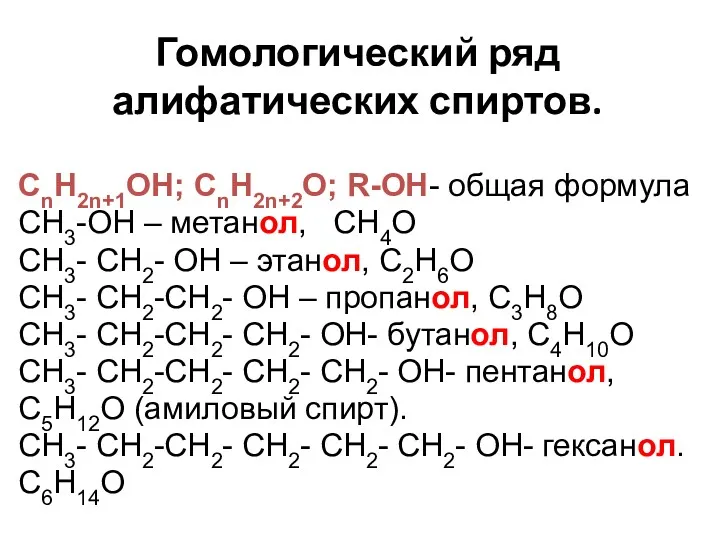
- 5. Гомологический ряд алифатических спиртов. СnH2n+1OH; СnH2n+2O; R-OH- общая формула CH3-OH – метанол, СH4O СH3- CH2- OH
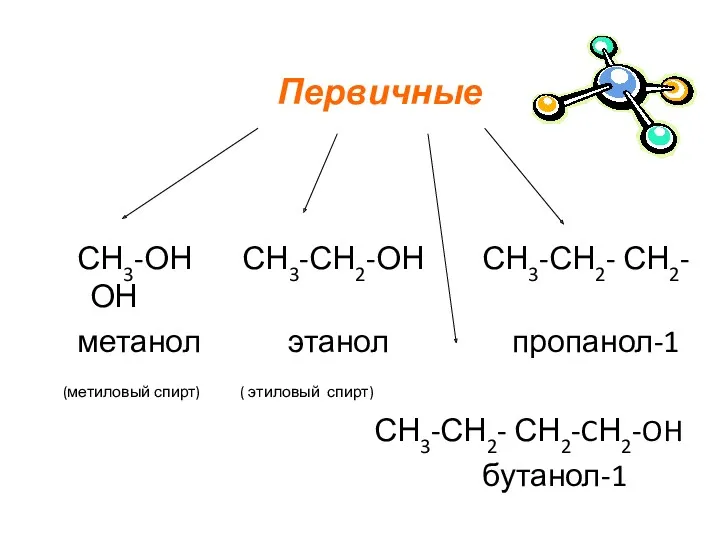
- 6. СН3-ОН СН3-СН2-ОН СН3-СН2- СН2-ОН метанол этанол пропанол-1 (метиловый спирт) ( этиловый спирт) СН3-СН2- СН2-CН2-OH бутанол-1 Первичные
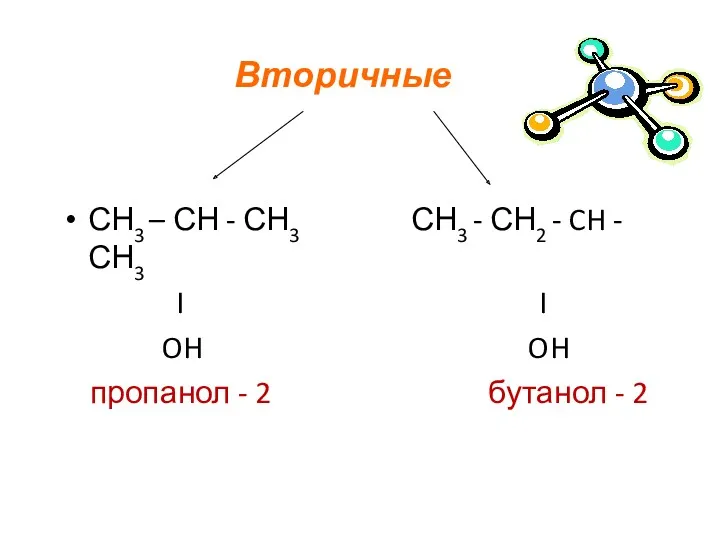
- 7. СН3 – СН - СН3 СН3 - СН2 - CH - СН3 I I OH OH
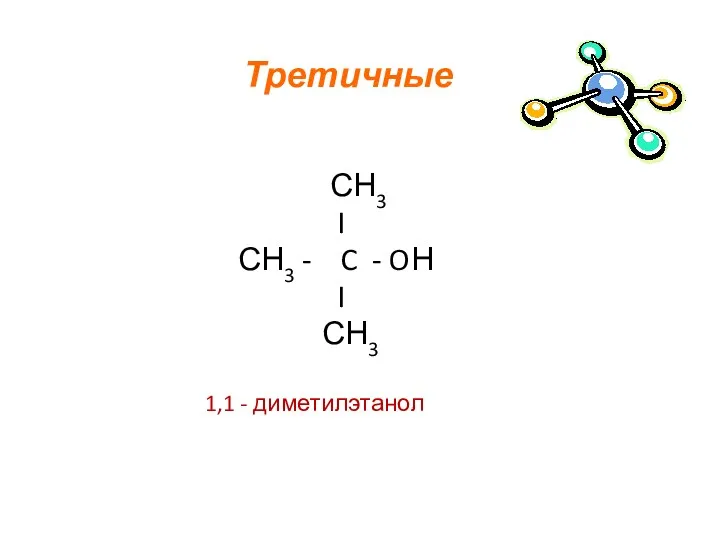
- 8. Третичные СН3 I СН3 - C - OН I СН3 1,1 - диметилэтанол
- 11. Ядовитость спиртов. Метиловый спирт – сильный яд! Несколько граммов его, попав в организм человека, вызывает слепоту,
- 12. Этиловый спирт(этанол) – бесцветная жидкость с характерным запахом. Спирт, содержащий 4-5% воды, называют ректификатом, а только
- 13. Спирты Физические свойства CH3CH2OH Этанол
- 14. Физические свойства спиртов Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического
- 15. Спирты от С1 до С12 по агрегатному состоянию – жидкости, высшие спирты – твердые вещества. В
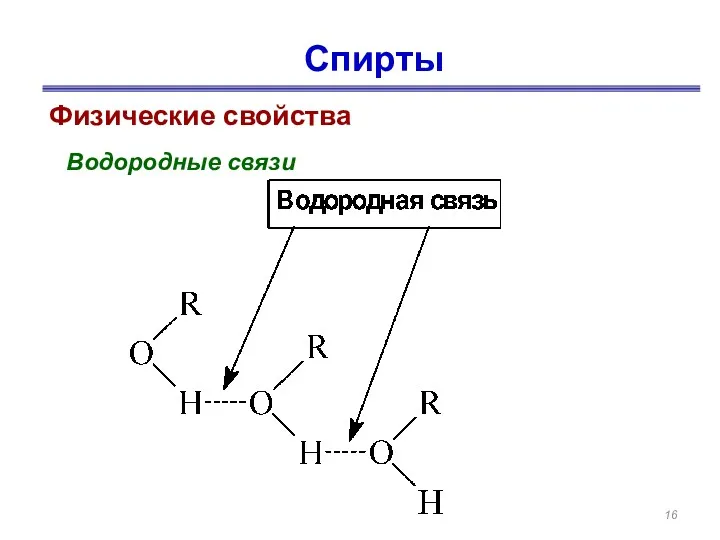
- 16. Спирты Физические свойства Водородные связи
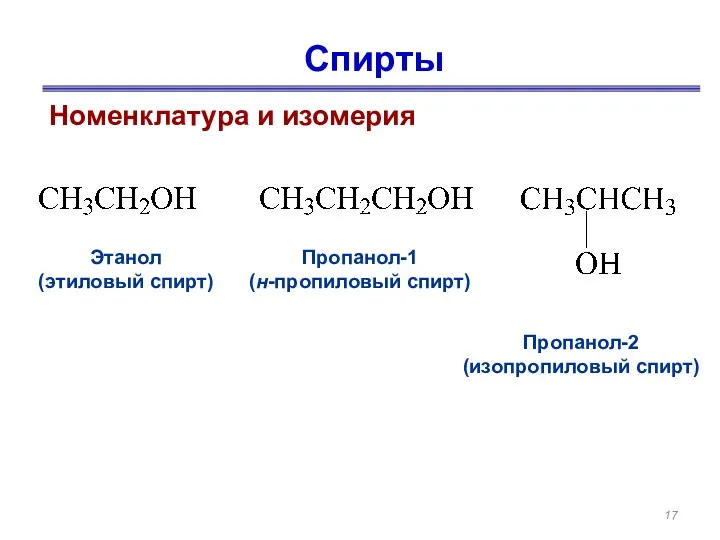
- 17. Спирты Номенклатура и изомерия Этанол (этиловый спирт) Пропанол-1 (н-пропиловый спирт) Пропанол-2 (изопропиловый спирт)
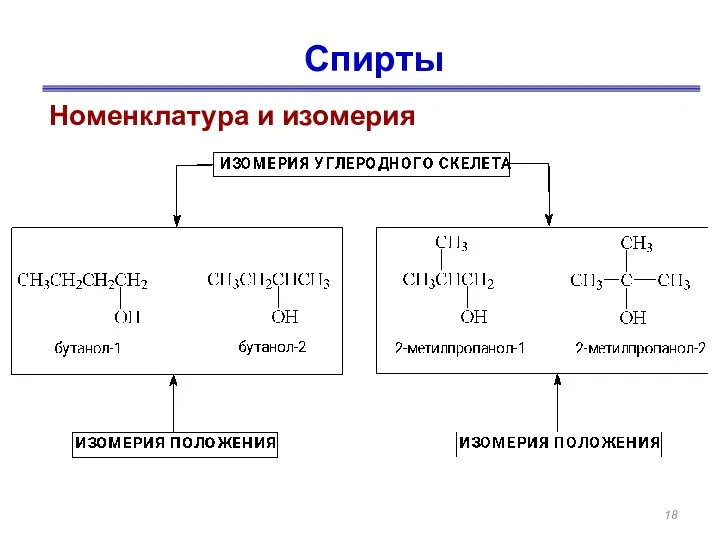
- 18. Спирты Номенклатура и изомерия
- 19. Способы получения Ферментативный синтез этанола. Этанол получают при брожении сахаров, вызываемом ферментами:
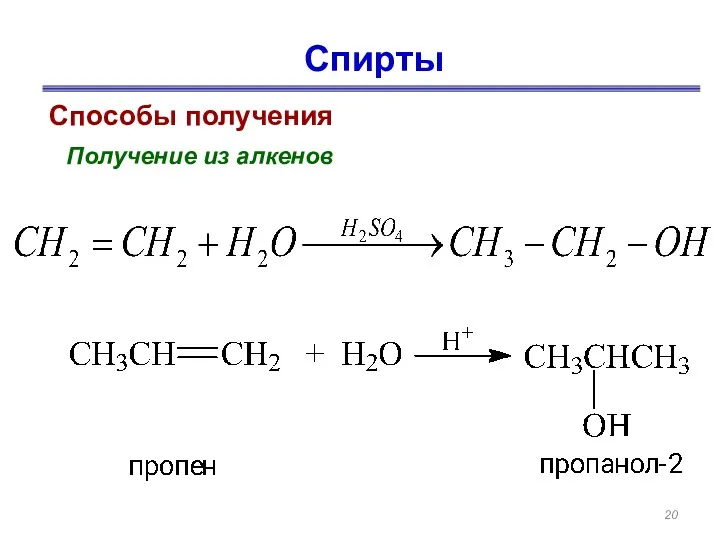
- 20. Спирты Способы получения Получение из алкенов
- 21. Метанол и этанол Смесь метана с водяным паром пропускают над катализатором.
- 22. Производство метанола https://www.youtube.com/watch?v=YXcShunkPps https://www.youtube.com/watch?v=7wDhHg7u1IU
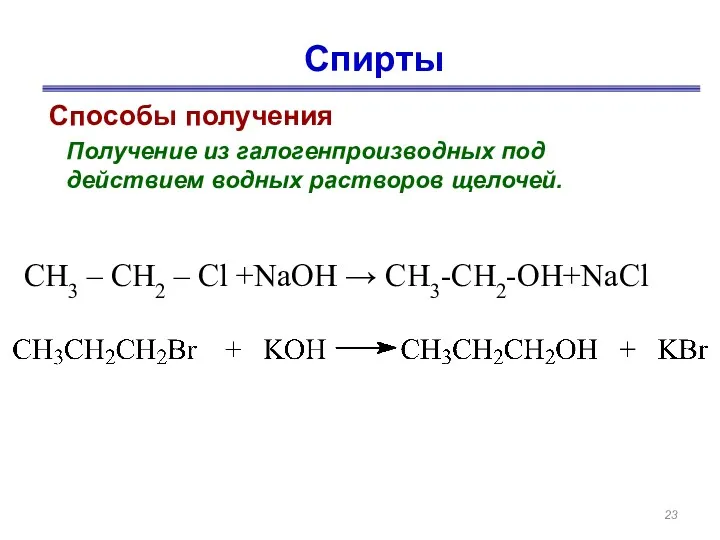
- 23. Спирты Способы получения Получение из галогенпроизводных под действием водных растворов щелочей. СН3 – СН2 – Cl
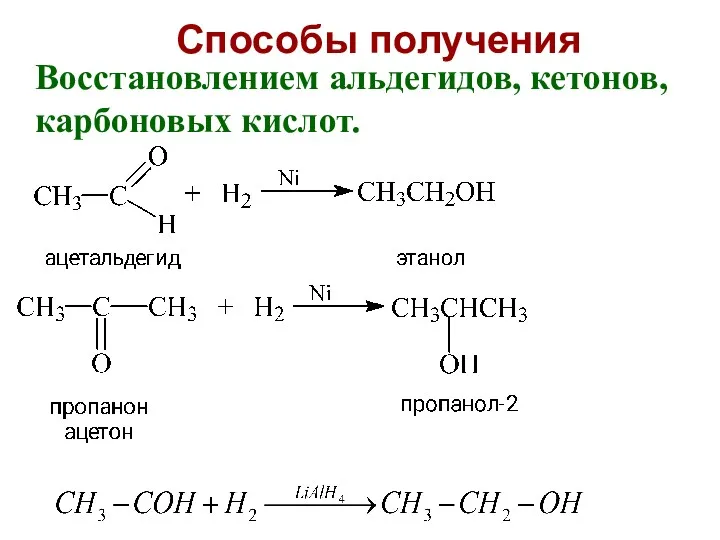
- 24. Способы получения Восстановлением альдегидов, кетонов, карбоновых кислот.
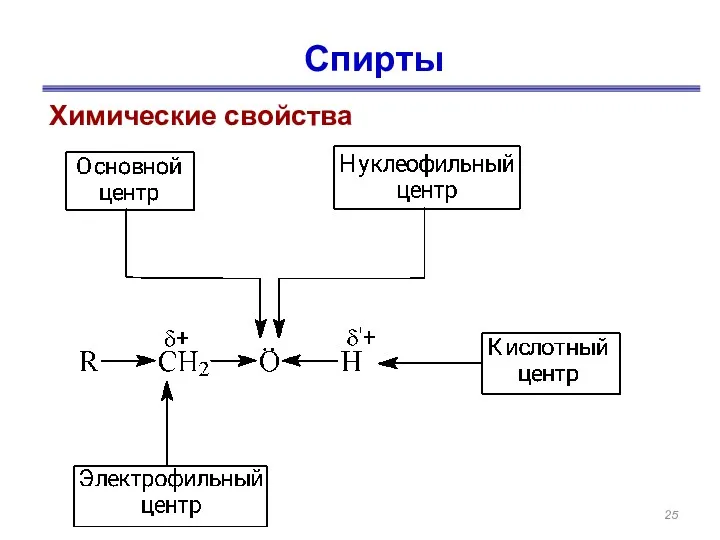
- 25. Спирты Химические свойства
- 26. Строение молекулы спиртов CH3-CH2 → O←H H-O-H Атом кислорода наиболее электроотрицателен по сравнению с углеродом и
- 27. Общая характеристика: соединения реакционноспособны благодаря наличию двух ковалентных связей O-H; C-O. Можно выделить следующие типы реакции:
- 28. Химические свойства спиртов Реакции замещения водорода функциональной группы Реакции замещения функциональной группы Внутримолекулярная дегидратация Реакции окисления
- 29. Реакции замещения водорода функциональной группы С увеличением углеводородного радикала, скорость этой реакции замедляется. В присутствии воды
- 30. Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной
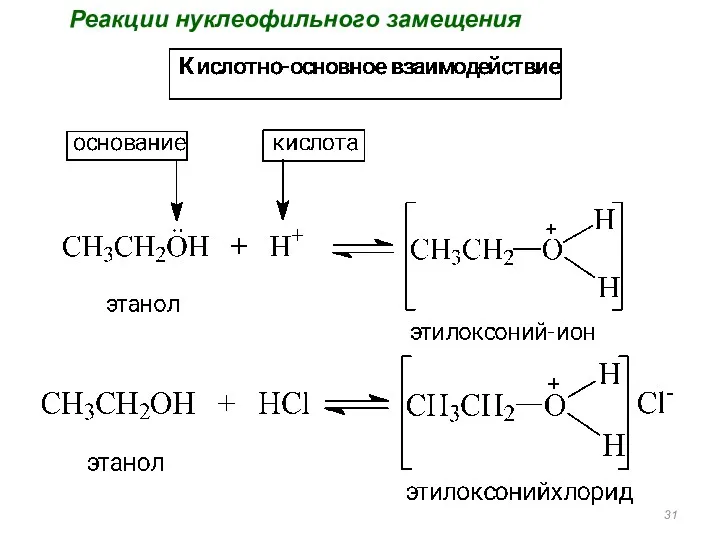
- 31. Реакции нуклеофильного замещения
- 33. Взаимодействие с галогенидами фосфора. C2H5OH + PCl5→ C2H5Cl + POCl3 + HCl хлорокись фосфора 3C2H5OH +
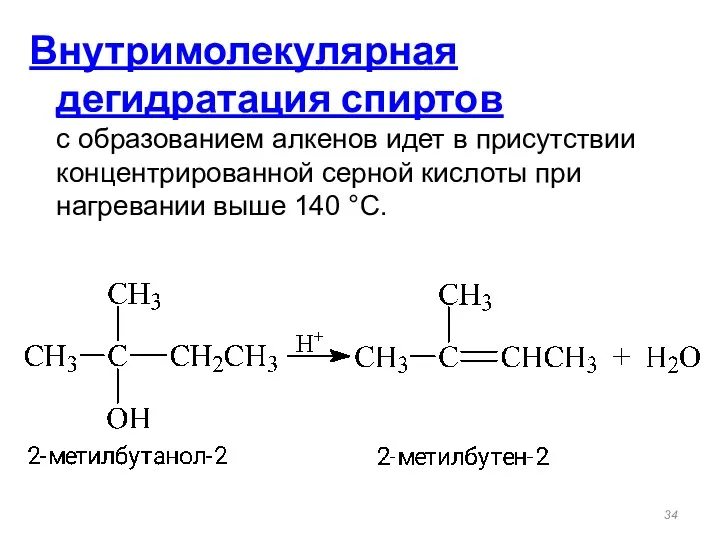
- 34. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140
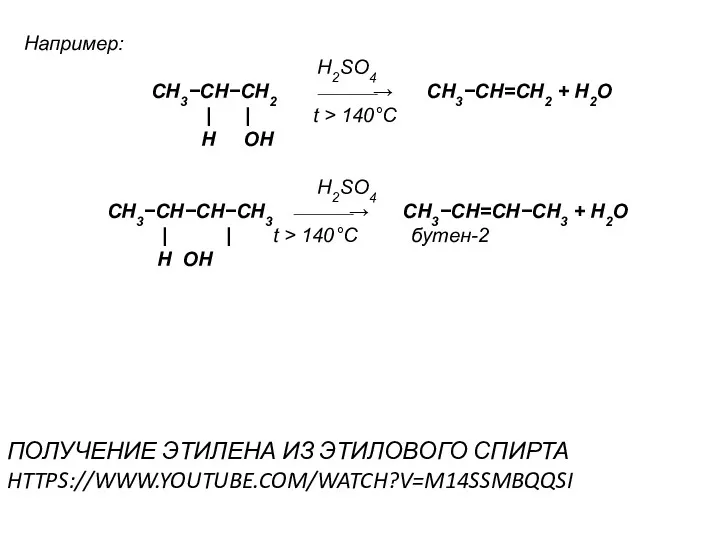
- 35. Например: H2SO4 CH3−CH−CH2 ⎯⎯⎯→ CH3−CH=CH2 + H2O | | t > 140°C H OH H2SO4 CH3−CH−CH−CH3
- 36. Межмолекулярная дегидратация с образованием простых эфиров (при нагревании ниже 140 °С): C2H5OH + HOC2H5 → C2H5-O-C2H5
- 38. При действии окислителей (KMnO4, K2Cr2O7+H2SO4) Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до
- 39. Реакции окисления сравните:
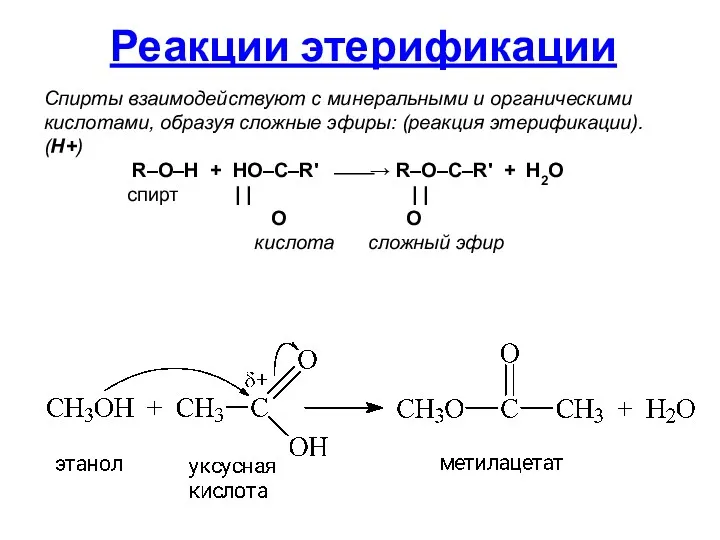
- 40. Спирты взаимодействуют с минеральными и органическими кислотами, образуя сложные эфиры: (реакция этерификации). (H+) R–O–H + HO–C–R'
- 41. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной кислоты; - растворитель. Этанол С2Н5ОН (этиловый спирт) - производство
- 42. Применение метанола https://www.youtube.com/watch?v=wG4FLlrmw7g
- 44. Скачать презентацию
























 Аммиак
Аммиак Химия p-элементов. VI и VII группы главные подгруппы
Химия p-элементов. VI и VII группы главные подгруппы Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Первичная переработка нефти
Первичная переработка нефти Нуклеиновые кислоты
Нуклеиновые кислоты Карбонаты
Карбонаты Спирты: общая характеристика
Спирты: общая характеристика Каликсарены
Каликсарены Кислородсодержащие соединения серы SO2
Кислородсодержащие соединения серы SO2 Политетрафторэтилен
Политетрафторэтилен Термодинамика
Термодинамика Арены. Бензол
Арены. Бензол Откуда берутся кристаллы
Откуда берутся кристаллы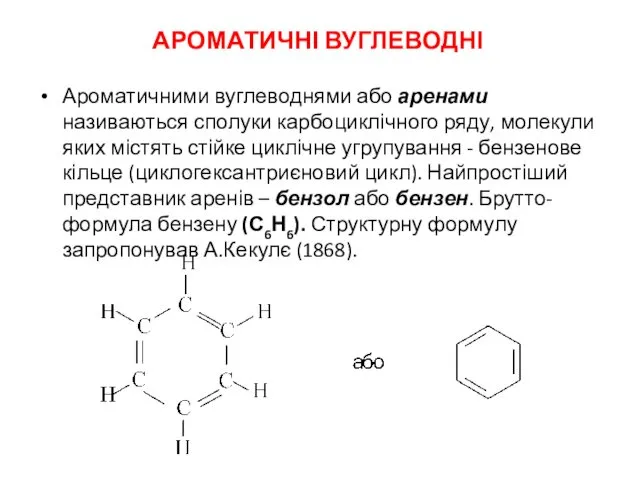 Ароматичні вуглеводні
Ароматичні вуглеводні Разбор заданий
Разбор заданий Облучение. Радиационная окраска
Облучение. Радиационная окраска Кислород
Кислород Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Нефть как природный источник углеводородов
Нефть как природный источник углеводородов Етилен і ацетилен – ненасичені вуглеводні
Етилен і ацетилен – ненасичені вуглеводні Массообменные процессы
Массообменные процессы Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук Соединения железа
Соединения железа Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Растворы. Свойства растворов. (Тема 3)
Растворы. Свойства растворов. (Тема 3) Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас