Содержание
- 2. Мета. Сформувати знання про окисно-відновні реакції. Сформувати поняття про процеси окиснення, відновлення. Навчити розрізняти які з
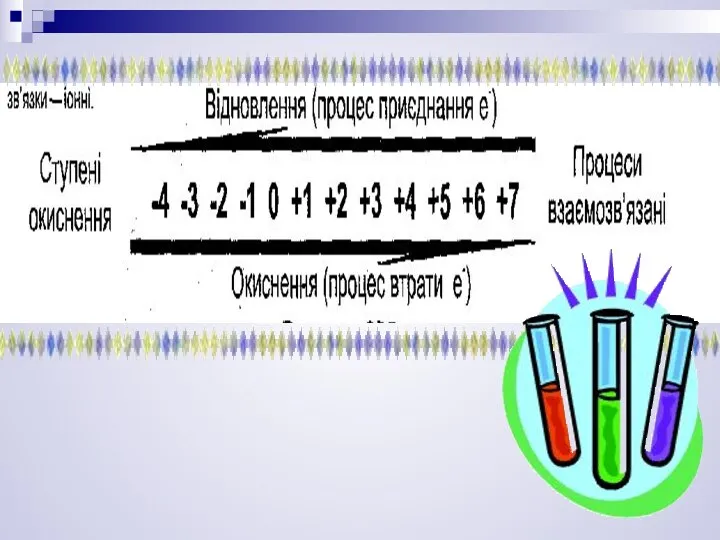
- 3. Ступінь окиснення (С.О.) — умовна величина, що показує заряд того чи іншого елемента в сполуці .
- 4. Найнижча с.о.= № групи –8 Нульова с.о.в простих речовинах. Позитивна с.о.= номеру групи.
- 5. С.о. Оксигену в оксиді =-2. С.о. Гідрогену в сполучені з неметалами=+1. С.о. металів 1 групи гол.підгр.
- 6. H2СO3 H С + О -2 + -2 Х 2 . (+1) + Х + 3
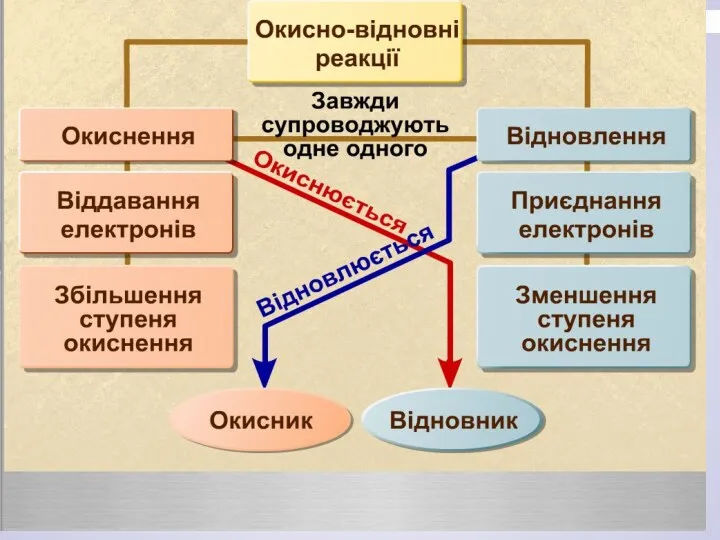
- 8. : Відновники – атоми, молекули або йони, що віддають електрони. Окисники - атоми, молекули або йони,
- 9. Окиснення: речовина A як відновник віддає один електрон
- 10. Відновлення: речовина В як окисник приймає електрон.
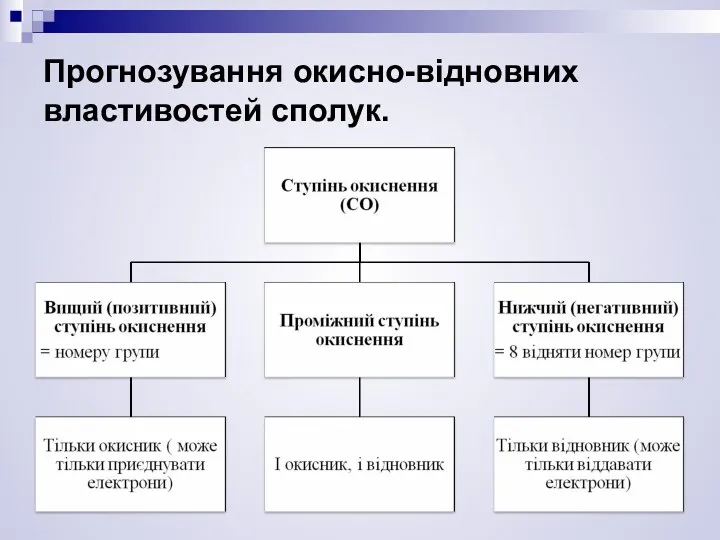
- 12. Прогнозування окисно-відновних властивостей сполук.
- 13. Ступені окиснення Cl -1, 0, +1, +3, +5, +7 лише і окисник, і лише окисниk відновник
- 14. P⁰ + 3e → P‾³ Na⁺ + 1e → Na⁰ Cl⁰ + 1e → Cl‾ Cl⁺⁷
- 15. Ba⁰ - 2e → Ba⁺² S‾² - 2e → S⁰ Fe⁺² - 1e→ Fe⁺³ Na⁰ -
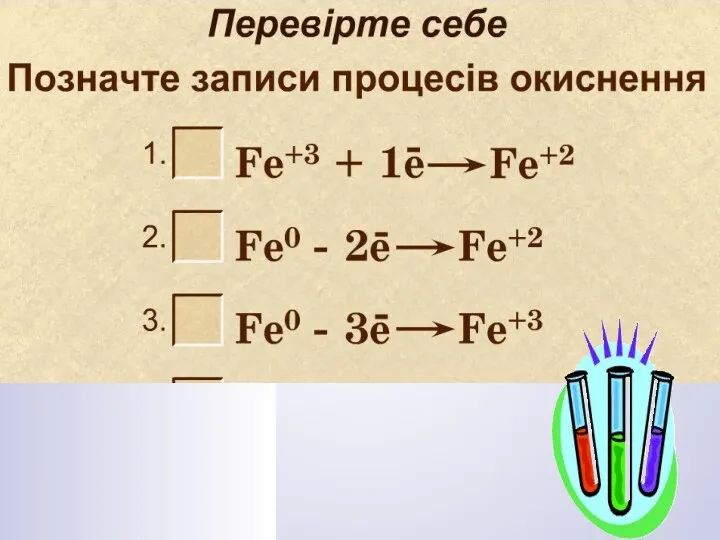
- 16. Які процеси відображають схеми?
- 17. Які процеси відображають схеми
- 21. Окисно-відновна реакція: речовина А віддає електрон речовині В.
- 22. Український вчений Лев Володимирович Писаржевський розробив теорію окисно-відновних реакцій. 1914 рік.
- 23. Мета. Сформувати знання про окисно-відновні реакції. Сформувати поняття про процеси окиснення, відновлення. Навчити розрізняти які з
- 24. Види окисно-відновних реакцій. внутрішньомолекулярні — реакції, в яких атоми— реакції, в яких атоми, що відновлюються та
- 25. . Алгоритм складання окисно – відновних реакцій: 1.Розставляємо ступені окиснення елементів. 2. Визначаємо елементи, що змінили
- 26. Довести, що реакція окисно-відновна, назвіть процеси та їх учасників. 1) Окиснення: відновник 2) Відновлення: окисник
- 27. Домашнє завдання: Вивчити п.16, завд.1,2 стор.92
- 29. Скачать презентацию






















 Изомеры – это вещества, имеющие одинаковый состав
Изомеры – это вещества, имеющие одинаковый состав Природный газ
Природный газ Благородные металлы
Благородные металлы Типы химических реакций
Типы химических реакций General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Свойства воды. Гидросфера
Свойства воды. Гидросфера Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Прості і складні речовини. Метали і неметали
Прості і складні речовини. Метали і неметали Металлы и сплавы
Металлы и сплавы Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si становление органической химии
становление органической химии Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Термодинамика
Термодинамика Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Су - тіршілік көзі
Су - тіршілік көзі Амінокислоти
Амінокислоти Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Скорость химических реакций
Скорость химических реакций Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ
Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Обобщение по типам химических реакций
Обобщение по типам химических реакций Теория электролитической диссоциации
Теория электролитической диссоциации Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Көміртек оксидтері
Көміртек оксидтері Химические реакции
Химические реакции Химическое равновесие. Классификация реакций по признаку обратимости
Химическое равновесие. Классификация реакций по признаку обратимости Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Гидроксид железа
Гидроксид железа