Содержание
- 2. Ознакомление с понятиями: электролитическая диссоциация, электролиты и неэлектролиты, ионы. Изучение сущности процесса электролитической диссоциации. Формирование навыков
- 3. План урока Электропроводность. Электролиты и неэлектролиты. Теория электролитической диссоциации. Уравнения электролитической диссоциации.
- 4. Актуализация знаний Вы уже знаете, что: Электрический ток — направленное движение заряженных частиц (электронов или ионов).
- 7. Диэлектрики — это вещества (материалы), которые плохо проводят или совсем не проводят электрический ток (резина, пластики,
- 8. По поведению в растворах и расплавах выделяют две группы веществ: Электролиты — вещества, растворы и расплавы
- 9. Электролитическая диссоциация Электролитическая диссоциация — это процесс распада электролита при растворении его в воде или расплавлении
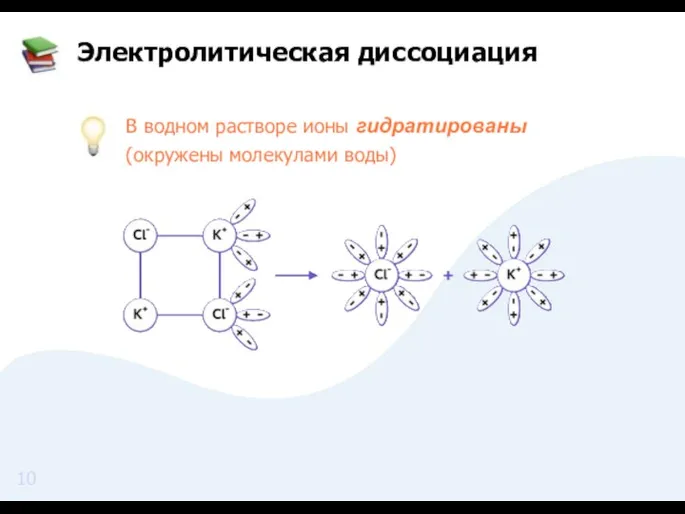
- 10. Электролитическая диссоциация В водном растворе ионы гидратированы (окружены молекулами воды)
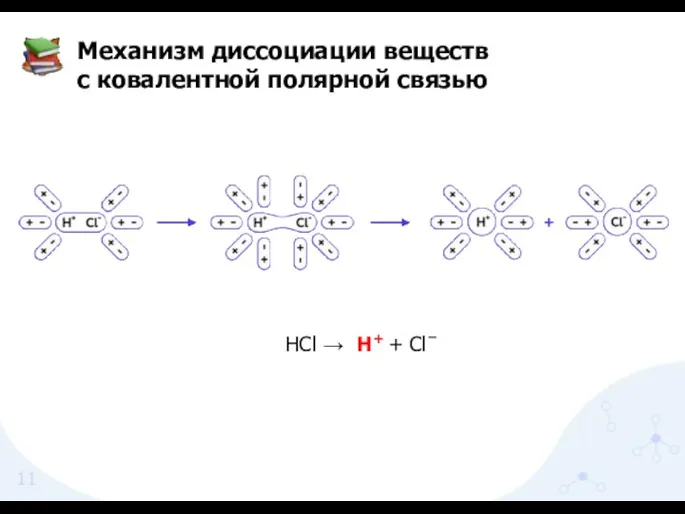
- 11. Механизм диссоциации веществ с ковалентной полярной связью HCl → H+ + Clˉ
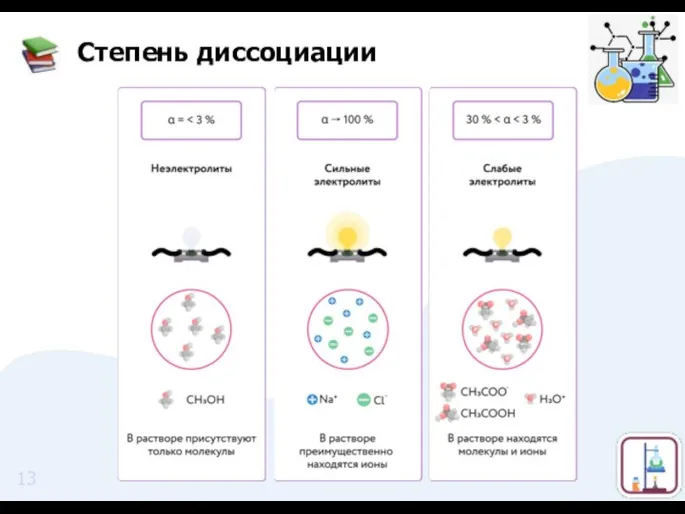
- 12. Степень диссоциации показывает отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. где α
- 13. Степень диссоциации
- 14. Сильные и слабые электролиты
- 15. Основные положения теории электролитической диссоциации При растворении в воде или в расплавленном состоянии электролиты диссоциируют (распадаются)
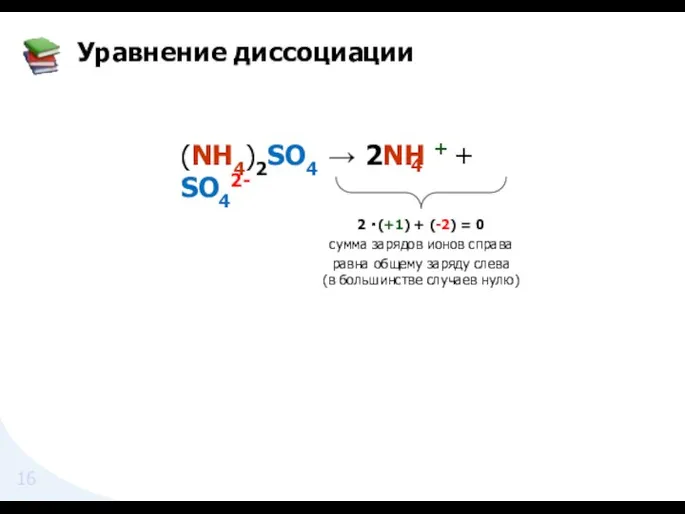
- 16. Уравнение диссоциации 4 (NH4)2SO4 → 2NH + + SO42- 2 ・(+1) + (-2) = 0 сумма
- 17. Диссоциация кислот Кислоты — это сложные вещества, при диссоциации которых в водных растворах в качестве анионов
- 18. Диссоциация многоосновных кислот Диссоциация преимущественно протекает по 1 ступени Многоосновные кислоты диссоциируют ступенчато H2SO4 ⟶ H+
- 19. Диссоциация оснований Основания — это сложные вещества , при диссоциации которых в водных растворах в качестве
- 20. Диссоциация средних солей Cоли — это сложные вещества, которые в водных растворах диссоциируют на катионы металлов
- 21. Ионы H+ образуются при диссоциации: NaOH H3PO4 CH4 H2 Задание
- 22. Ионы OH- образуются при диссоциации: HClO KOH Na2SO4 H2SO4 Задание
- 23. Из предложенного списка веществ выберите сильные электролиты: HNO2 Fe(OH)3 HNO3 Ba(OH)2 P2O5 KMnO4 Задание
- 24. Выберите уравнения электролитической диссоциации, которые записаны верно: NaNO3 → Na+ + NO3- 2HgO → 2Hg +
- 25. При диссоциации каких электролитов образуется больше положительных ионов, чем отрицательных: сульфат меди(II) Хлорид алюминия сульфат железа(III)
- 26. При диссоциации какого электролита образуется поровну катионов и анионов: Гидроксид бария Сульфат магния Карбонат лития Хлорид
- 27. При диссоциации электролита образовалось в 1,5 раза больше отрицательных ионов, чем положительных. Выберите соответствующее вещество из
- 28. Задание Запишите уравнения диссоциации веществ: MgSO4 ……………………………...…………………………...……………………… AlCl3 ……………………………...…………………………...………………………… HNO2 ……………………………...………………………………………………….… K3PO4 ……………………………...……………………………………………..…… Ba(OH)2 ……………………………...……………………………………….……… H2SO4
- 30. Скачать презентацию






















 Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Щавелевая кислота
Щавелевая кислота Химическая связь
Химическая связь Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Дистилляция в химической промышленности
Дистилляция в химической промышленности Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Соли
Соли Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Кислородные соединения углерода
Кислородные соединения углерода Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Лекарства дома
Лекарства дома Каменный уголь. Фенол
Каменный уголь. Фенол Коллигативные свойства растворов
Коллигативные свойства растворов Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Адсорбция. Раздел III
Адсорбция. Раздел III Литий. Физические свойства лития
Литий. Физические свойства лития Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Атомы и молекулы
Атомы и молекулы Типы химических реакций
Типы химических реакций