Содержание
- 2. Обсуждаемые вопросы: 1.Определение. Правила составления формул солей. 2. Классификация солей 3. Химические свойства солей 4. Способы
- 3. Соли- сложные неорганические соединения, состоящие из катиона металла (на первом месте) и аниона кислотного остатка (на
- 4. Классификация и номенклатура солей 1. Чтобы назвать соль, надо сначала назвать анион кислотного остатка (см сайд
- 5. Химические свойства солей(учим!!!) 1. Соли более слабых кислот реагируют с более сильными кислотами (знаем!!! См химические
- 6. способы получения солей Взаимодействие металлов с неметаллами (знаем!) Взаимодействие металлов с кислотами (знаем!) Взаимодействие металлов с
- 7. ИТОГО: Прочесть параграфы в учебнике Изучить презентацию. Здесь «Выжимки» из учебника. ТО, что надо ЗНАТЬ! Максимально
- 9. Скачать презентацию






 Стратегия химической промышленности
Стратегия химической промышленности Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Химия в повседневной жизни человека
Химия в повседневной жизни человека Емтихан сұрақтары
Емтихан сұрақтары Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Классификация химических реакций
Классификация химических реакций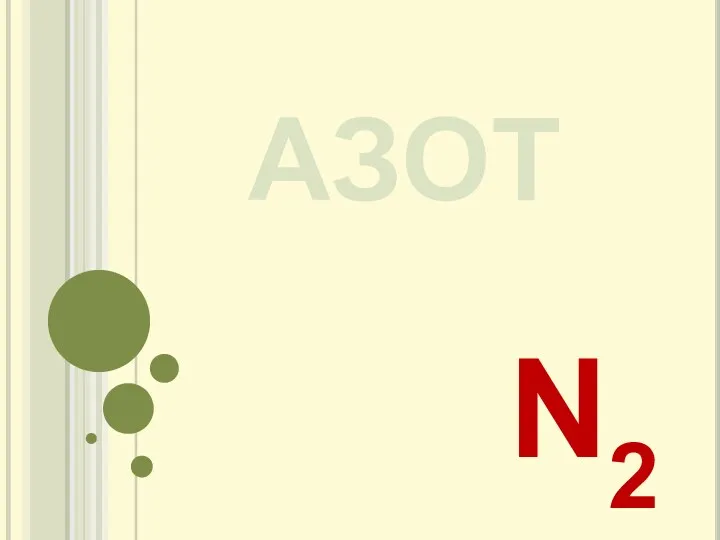 20230419_azot
20230419_azot Органикалық қосылыстар
Органикалық қосылыстар Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Металлы побочных подгрупп
Металлы побочных подгрупп Периодический закон и система элементов Д.И. Менделеева
Периодический закон и система элементов Д.И. Менделеева Минералы горных пород
Минералы горных пород Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения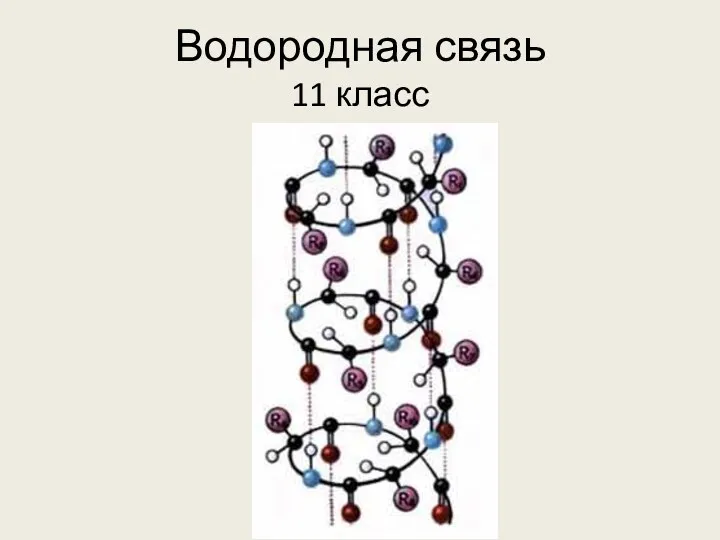 Водородная связь
Водородная связь Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Амины. Анилин
Амины. Анилин Шкала не Мооса
Шкала не Мооса Растворы. Лекция №4
Растворы. Лекция №4 Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Нефть, её производство, авиационное и дизельное топливо
Нефть, её производство, авиационное и дизельное топливо Органическая химия. Лекция 13
Органическая химия. Лекция 13 Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Химия. D-элементтер
Химия. D-элементтер сложные эфиры
сложные эфиры Күрделі белоктар
Күрделі белоктар Простые вещества. Сложные вещества
Простые вещества. Сложные вещества