11. Электродтық потенциал. Нернст теңдеуі. Электродтар түрі. Гальвани-калық элементтер теориясы.
12. Электролиз.
1) Массасы 120 г ерiтiндiде 24 г калий гидроксидi бар болса, осы ерiтiндiнiң массалық үлесi қандай (ω, %)?
2) 160 г суда 40 г тұз ерiтiлген. Ерiтiндiдегi заттың массалық үлесi қандай (ω, %)?
3) 250 мл ерiтiндiдегi 10,5 г натрий фторидiнiң нормалдық концентрациясы неге тең? MNaF=42 г/моль.
4)Күштi электролиттi көрсетiңiз?
5) 400 г 50 % H2SO4 ерiтiндiсiнен (массасы бойынша) буландырып 100 г суды бөлiп алдық. Қалған ерiтiндiдегi H2SO4 массалық үлесi (%) неге тең?
Бақылау жұмысы








 Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Сполуки фосфору
Сполуки фосфору Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Природные источники углеводородов
Природные источники углеводородов Альдегиды и кетоны
Альдегиды и кетоны Закон Авогадро. Молярный объем газов
Закон Авогадро. Молярный объем газов Разбираем задания
Разбираем задания Типы химических реакций
Типы химических реакций Виды химической связи
Виды химической связи Химический элемент уран
Химический элемент уран Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи Природный и синтетический каучуки. Резина
Природный и синтетический каучуки. Резина Кристаллы и минералы
Кристаллы и минералы Чистые вещества и смеси
Чистые вещества и смеси Мінеральні добрива
Мінеральні добрива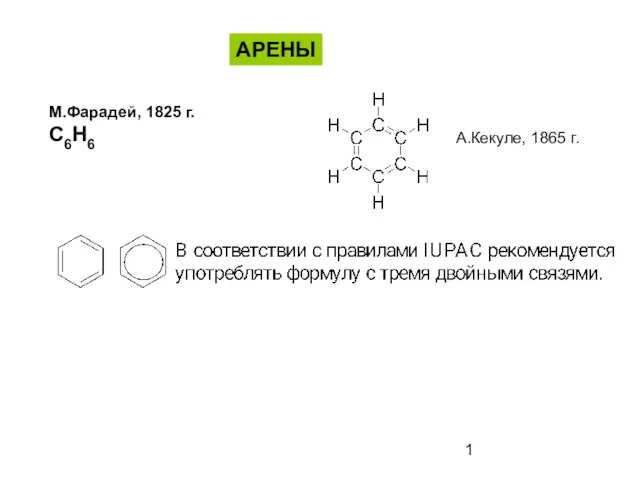 Ароматические соединения - арены
Ароматические соединения - арены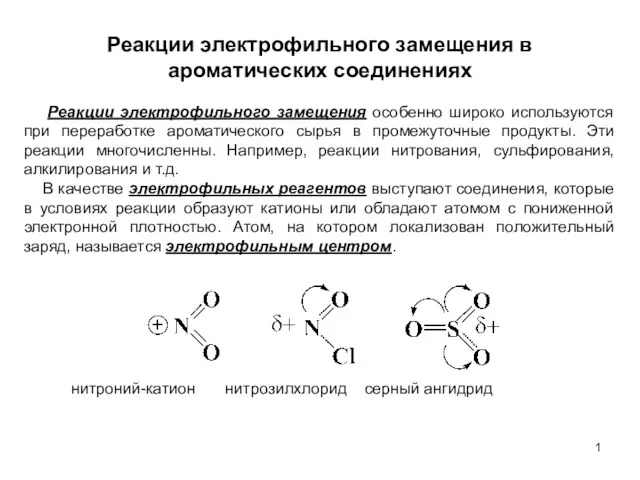 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Задачи, включаемые в задание 33 тестов ЕГЭ
Задачи, включаемые в задание 33 тестов ЕГЭ Медь. Физические свойства
Медь. Физические свойства Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов Исследование снега
Исследование снега Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Энергетика химических реакций
Энергетика химических реакций Секреты чая в пакетиках
Секреты чая в пакетиках