Содержание
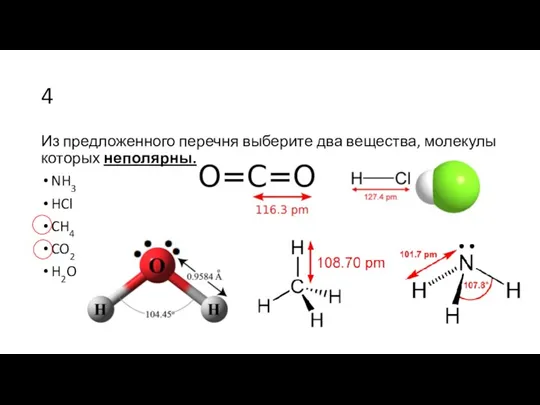
- 2. 4 Из предложенного перечня выберите два вещества, молекулы которых неполярны. NH3 HCl CH4 CO2 H2O
- 3. 4 Из предложенного перечня выберите два вещества с молекулярной кристаллической решеткой в твердом состоянии: Из предложенного
- 4. 8 Установите соответствие между простым веществом и реагентами, с каждым из которых оно может реагировать: к
- 5. 25 Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к
- 6. 25 Установите соответствие между парами веществ и реагентами, с помощью которых их можно различить: к каждой
- 7. 26 Установите соответствие между смесью и способом её разделения: к каждой позиции, обозначенной буквой, подберите соответствующую
- 8. 26 Установите соответствие между процессом и используемым при этом катализатором: к каждой позиции, обозначенной буквой, подберите
- 9. 26 Установите соответствие между названием полимера и признаком его классификации: к каждой позиции, обозначенной буквой, подберите
- 10. 30 FeO + KClO3 = Fe2O3 + KCl 3 6 +2 +3 +5 -1 2Fe+2 -2e=Fe2+3
- 11. 30 KCl+ KClO3 + H2SO4= Fe2(SO4)3 + KCl + H2O 3 6 -1 +3 +5 -1
- 12. 30 KCl + KClO3+ H2SO4= K2SO4+ Cl2 + H2O 3 5 -1 0 +5 2Cl- -2e=Cl20
- 13. 31 H2SO4+(NH4)2CO3=(NH4)2SO4+ CO2+H2O 2H+ + SO4-+ 2NH4+ +CO32-= 2NH4+ + SO4- + CO2+ H2O Полное ионное
- 14. 31 серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ. Na2CO3+2HMnO4=2NaMnO4+ CO2+H2O
- 15. H2O + S SO2+ Br2+ H2O= H2SO4+ HBr 32 При обжиге некоторого минерала А, состоящего из
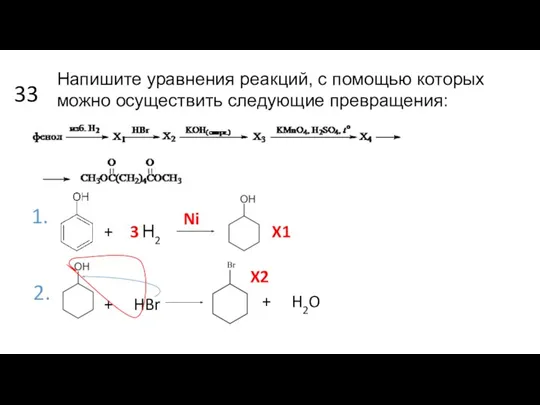
- 16. 33 1. + Н2 3 Ni 2. X1 + HBr + H2O X2
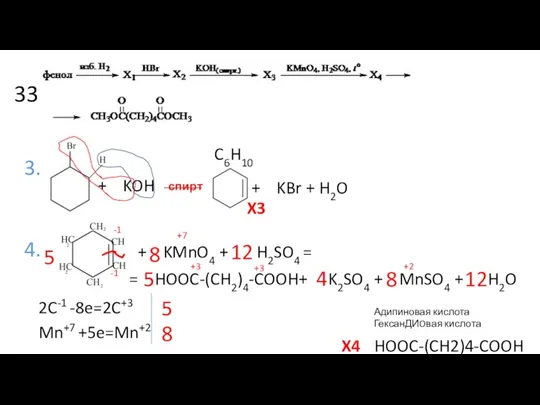
- 17. 33 3. спирт 4. + KOH + KBr + H2O C6H10 + KMnO4 + H2SO4 =
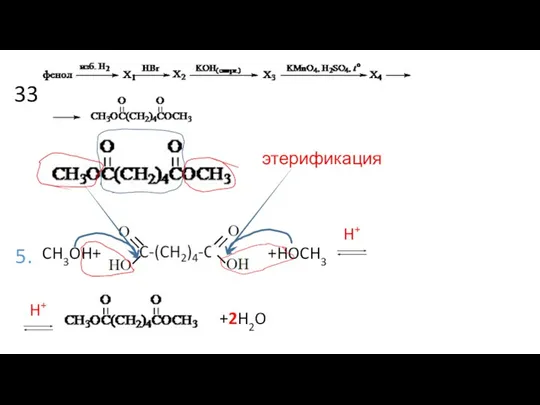
- 18. 33 5. этерификация CH3OH+ +2H2O +HOCH3 H+ H+
- 19. 34 Электролиз 400 г 14,9%-го раствора хлорида калия продолжали до тех пор, пока на катоде не
- 20. 34 Электролиз 400 г 14,9%-го раствора хлорида калия продолжали до тех пор, пока на катоде не
- 21. 35 При полном сгорании органического вещества массой 25,9 г образовалось 23,52 л (при н. у.) углекислого
- 22. 35 При полном сгорании органического вещества массой 25,9 г образовалось 23,52 л (при н. у.) углекислого
- 24. Скачать презентацию

















 Классификация удобрений
Классификация удобрений Минерал хромдиопсид. Месторождения
Минерал хромдиопсид. Месторождения Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Спирти
Спирти Ионные уравнения
Ионные уравнения Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Хімічні властивості металів
Хімічні властивості металів Железо и его соединения
Железо и его соединения Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Минералы и горные породы
Минералы и горные породы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Валентность химических элементов
Валентность химических элементов Теория сплавов
Теория сплавов Хром. Свойства
Хром. Свойства Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Нефть и способы её переработки
Нефть и способы её переработки Действующие вещества. Лексикон
Действующие вещества. Лексикон Реакції йонного обміну між електролітами у водних розчинах
Реакції йонного обміну між електролітами у водних розчинах Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7