Содержание
- 3. электронная формула +24Cr 1s2|2s22p6|3s23p63d5|4s1 Запомните!
- 4. Физические свойства Хром - серебристо-белый металл. Температура плавления 1890оС, плотность 7,19 г/см3. Чистый хром достаточно пластичен,
- 5. Химические свойства Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя
- 7. Запомните! Раскалённый хром реагирует с парами воды: 2Сr + ЗН2О = Сг2О3 + ЗН2 * соли
- 8. Оксиды и гидроксиды хрома: Хром образует следующие оксиды и гидроксиды: СrO Сг(ОН)2 Сг2O3 Сг(ОН)3 CrO3 Н2СrO4
- 9. Оксид хрома (II) СгО и соответствующий ему Сг(ОН)2, проявляют основные свойства: СrO + 2HCI = CrCl2
- 10. Cr(OH)2 = CrO + H2O 3CrO=Cr + Cr2o3 Примеры
- 11. оксид хрома (III) Сг2О3 и гидроксид хрома (III) Сг(ОН)з - амфотерные соединения. Сг2О3 - тугоплавкий порошок
- 12. С кислотами Cr2O3 и Cr(OH)3 дают соли хрома (III): Cr2O3 + 6HCl = 2CrCl3 + 3Н2О
- 13. Оксид хрома (VI) СгО3 - кислотный оксид. Получение: К2Сг2О7 + H2SO4 = 2CrO3 + K2SO4 +
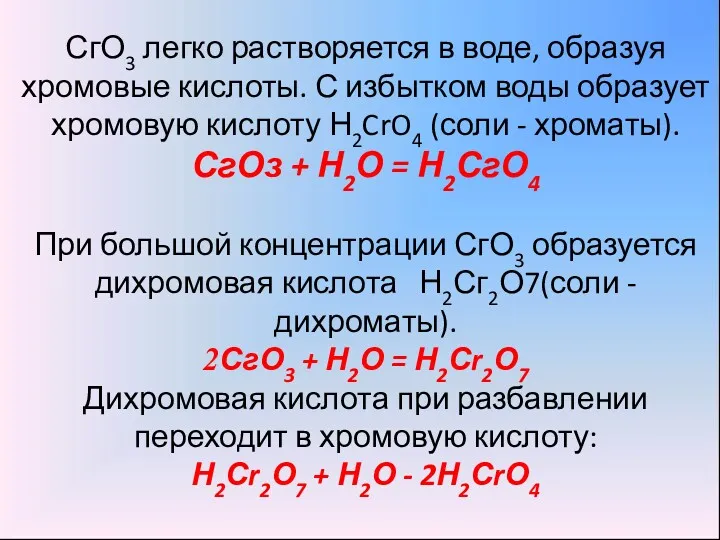
- 14. СгО3 легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту Н2CrO4 (соли
- 15. Хромовые кислоты существуют только в водном растворе. С возрастанием степени окисления основные свойства гидроксидов ослабевают, а
- 16. Дихроматы получаются при действии на хроматы кислот: 2 Na2Cr2O4 + H2SO4 = Na2Cr2O7 + Na2SO4 +
- 17. Запомните! В кислых растворах существуют преимущественно дихроматы (растворы оранжевого цвета), а в щелочных - хроматы (растворы
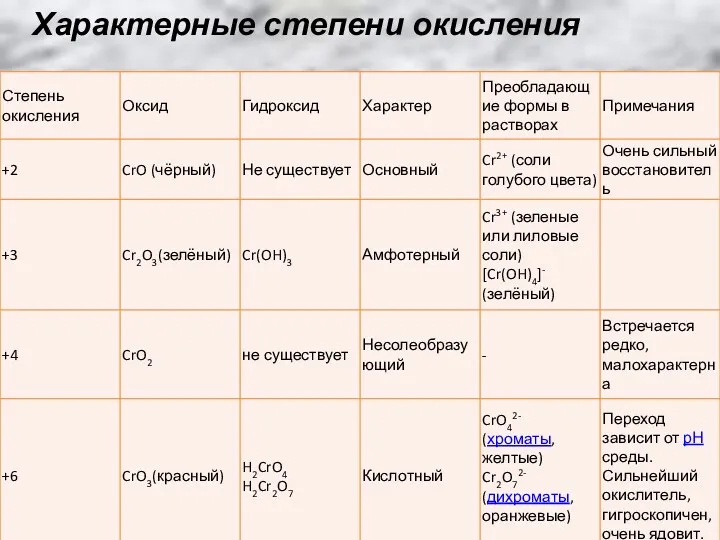
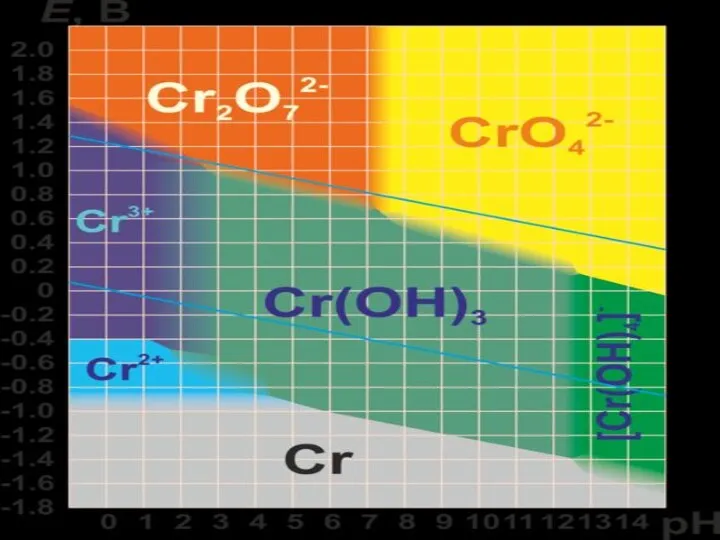
- 20. Характерные степени окисления
- 23. Скачать презентацию

















 Валентность и степень окисления
Валентность и степень окисления Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Строение вещества. Химические элементы
Строение вещества. Химические элементы Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Химическая связь
Химическая связь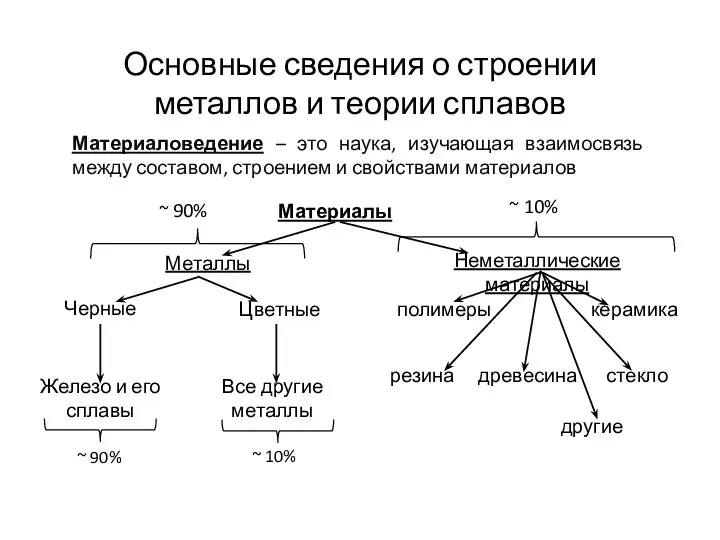 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Углеводы. Моносахариды
Углеводы. Моносахариды Виды химических реакций
Виды химических реакций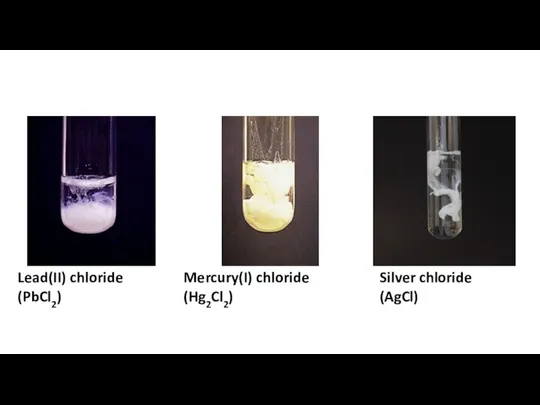 Separation amp confirmation
Separation amp confirmation Карбонаты
Карбонаты Hydrochloric acid HCl
Hydrochloric acid HCl Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Оксид фосфора P2O5
Оксид фосфора P2O5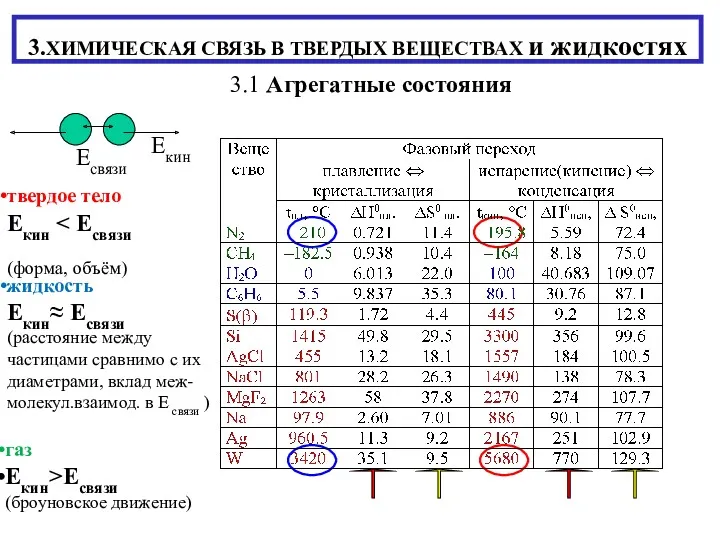 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Описание основных типов магматических горных пород
Описание основных типов магматических горных пород Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Классы неорганических веществ. Лекция №2
Классы неорганических веществ. Лекция №2 Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Чистые вещества и смеси
Чистые вещества и смеси