Содержание
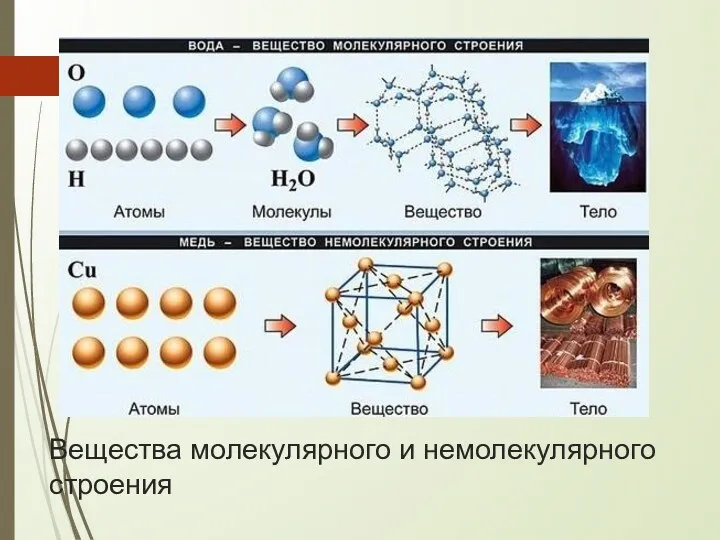
- 2. Вещества молекулярного и немолекулярного строения
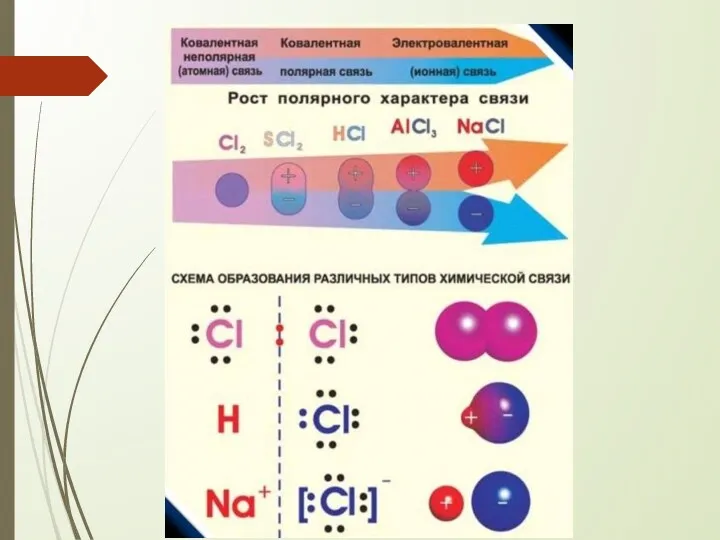
- 3. Виды химической связи
- 4. Химическая связь 1) имеет электромагнитную природу 2) в результате образования связи происходит понижение энергии системы
- 5. 1. Ковалентная связь Наиболее прочный тип химической связи Есв до 800 кДж/моль
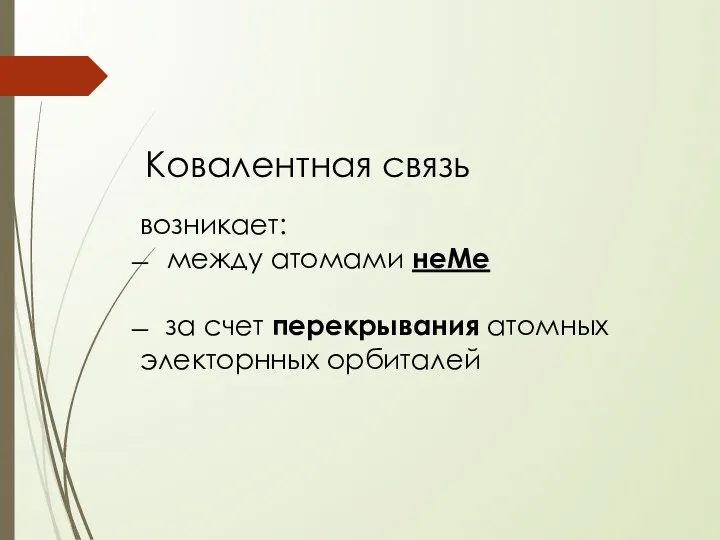
- 6. Ковалентная связь возникает: ̶ между атомами неМе ̶ за счет перекрывания атомных электорнных орбиталей
- 7. Ковалентная связь при этом образуются: ̶ общая для двух атомов электронная пара, ̶ молекулярная орбиталь.
- 8. Электроотрицательность (ЭО) это способность атомов, принимающих участие в образовании ковалентной связи, притягивать к себе общую электронную
- 9. Электроотрицательность (ЭО) чем больше разница в значениях ЭО связанных атомов, тем больше полярность ковалентной связи
- 10. Фрагмент ряда относительной ЭО элементов
- 11. 1а. Ковалентная неполярная связь
- 12. Ковалентная неполярная связь образуется между одинаковыми атомами неМе общая е-пара: расположена симметрично относительно центров атомов в
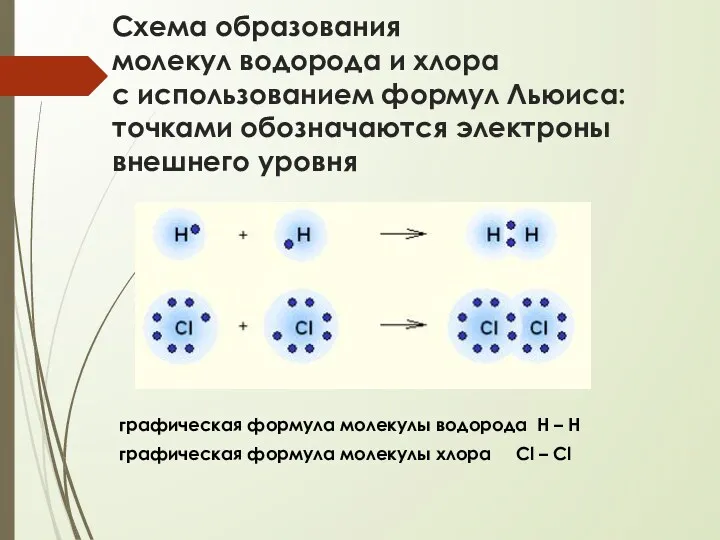
- 13. Схема образования молекул водорода и хлора с использованием формул Льюиса: точками обозначаются электроны внешнего уровня графическая
- 14. 1б. Ковалентная полярная связь
- 15. Ковалентная полярная связь образуется между атомами неМе с различной ЭО общая е-пара: сдвинута в сторону атома
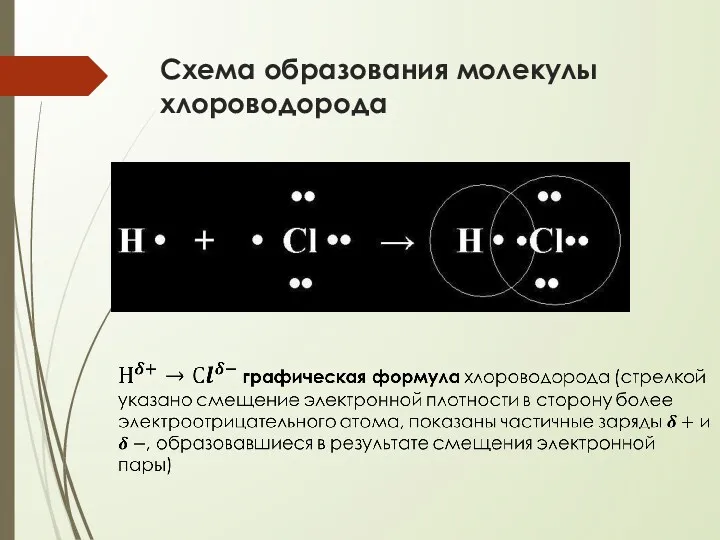
- 16. Схема образования молекулы хлороводорода
- 17. 2. Ионная связь Есв около 600 кДж/моль
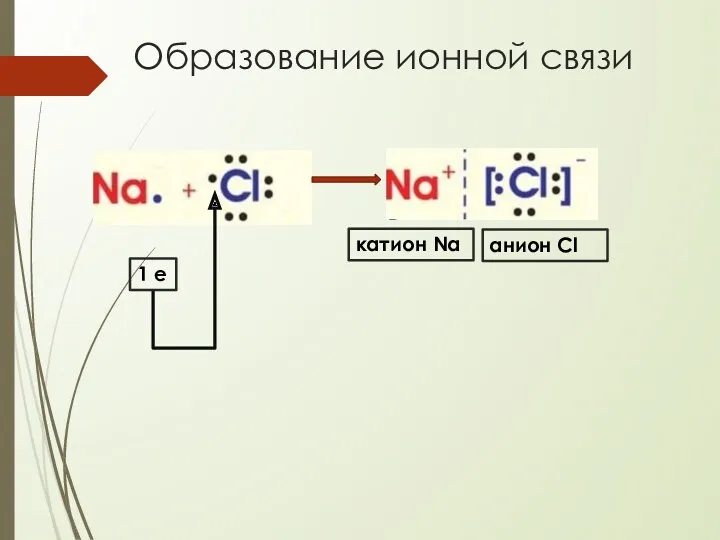
- 18. Ионная связь осуществляется за счет электростатического притяжения образовавшихся разноименных ионов (катионов и анионов)
- 19. Ионная связь предельный случай ковалентной полярной связи (если Δ ЭО взаимодействующих атомов ≥ 1,7) возникает между
- 20. Образование ионной связи 1 е катион Na анион Cl
- 23. Скачать презентацию














 Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Аминокислоты. Что нужно для настоящего атлета?
Аминокислоты. Что нужно для настоящего атлета? Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Строение и свойства циклоалканов
Строение и свойства циклоалканов ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Алкани, насичені вуглеводні
Алкани, насичені вуглеводні Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Установка по переработке углеводородов
Установка по переработке углеводородов Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Водород. Урок химии
Водород. Урок химии Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Темір. Жай заттармен
Темір. Жай заттармен Дисперсные системы
Дисперсные системы Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Серебро. История
Серебро. История Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Полистирол өндірісі
Полистирол өндірісі