Содержание
- 2. Девиз урока
- 3. Цель урока Повторить химические свойства оксидов, кислот, оснований , солей. Рассмотреть уравнения реакций в свете окислительной-восстановительной
- 4. Химические свойства оксидов Вспомните, с какими веществами взаимодействуют оксиды? Основные оксиды С кислотами С водой С
- 5. Химические свойства основных оксидов Взаимодействуют с кислотами +2 -2 +1 +6 -2 t +2 +6 -2
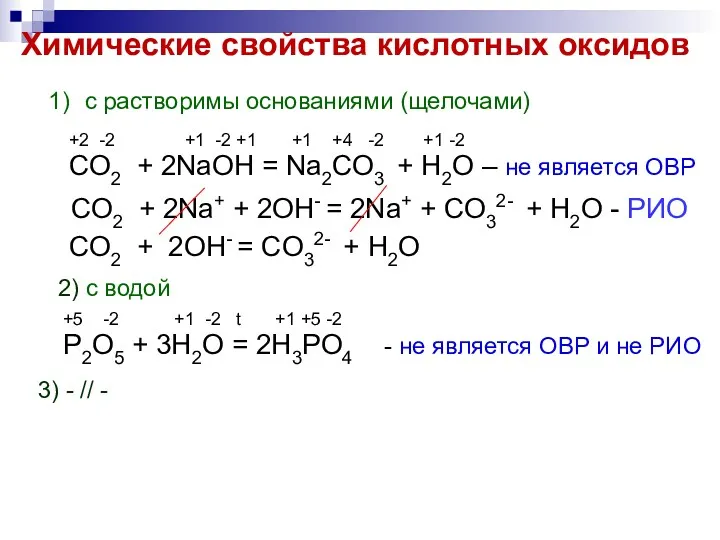
- 6. Химические свойства кислотных оксидов с растворимы основаниями (щелочами) +2 -2 +1 -2 +1 +1 +4 -2
- 7. Химические свойства кислот Вспомните, с какими веществами взаимодействуют кислоты ? с металлами с основными оксидами с
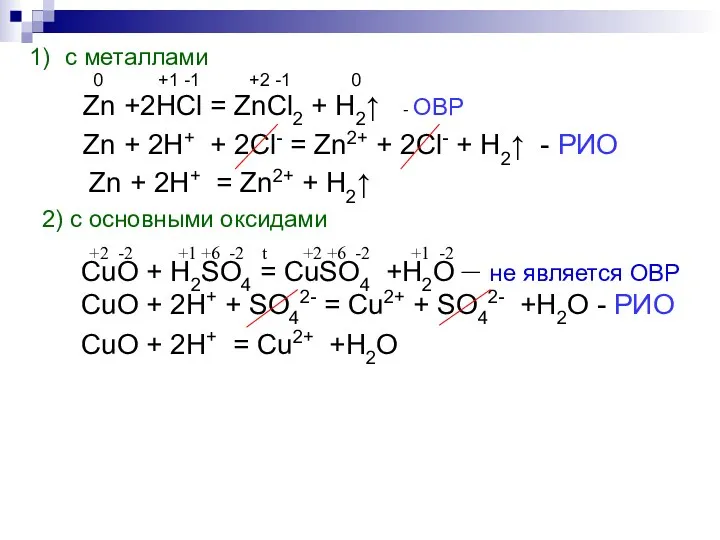
- 8. с металлами 0 +1 -1 +2 -1 0 Zn +2HCl = ZnCl2 + H2↑ - ОВР
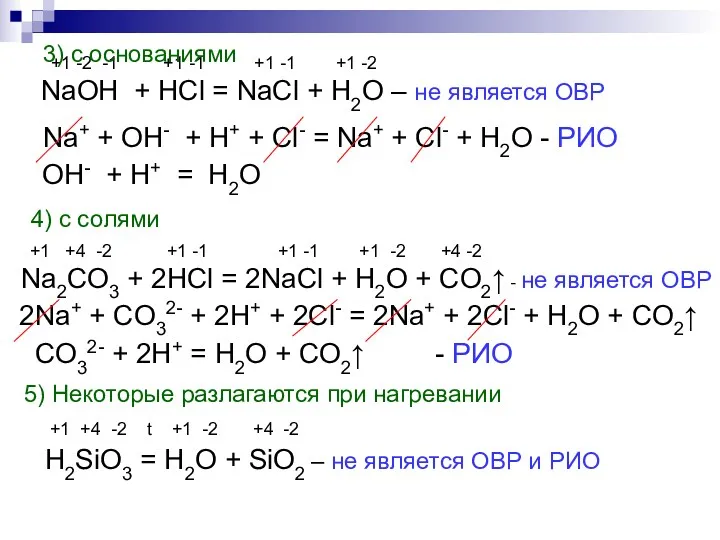
- 9. +1 -2 -1 +1 -1 +1 -1 +1 -2 NaOH + HCl = NaCl + H2O
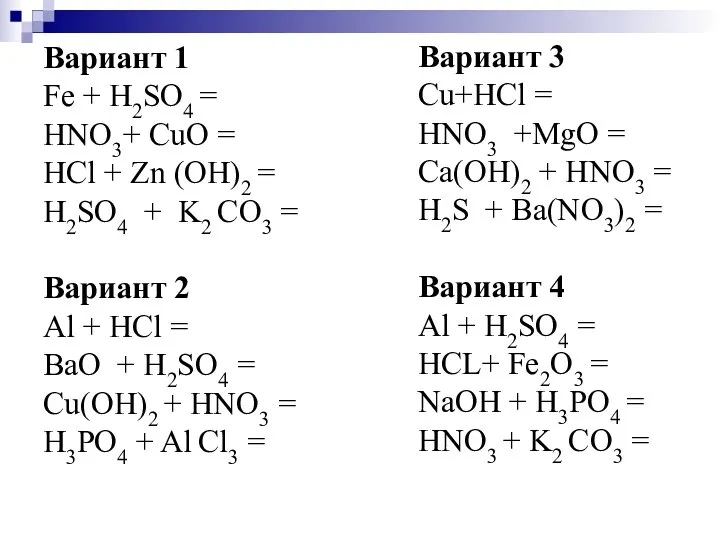
- 10. Вариант 1 Fe + H2SO4 = HNO3+ CuO = HCl + Zn (OH)2 = H2SO4 +
- 11. Вариант 1 Fe + H2SO4 = FeSO4 + H2 HNO3+ CuO = Cu(NO3)2 + H2O HCl
- 12. Химические свойства оснований
- 13. Цель урока Повторить химические свойства оснований. Рассмотреть уравнения реакций в свете электролитической диссоциации; Уметь писать полные
- 14. Химические свойства оснований Вспомните, с какими веществами взаимодействуют основания? с кислотами растворимые основания (щелочи) с солями
- 15. Химические свойства оснований с кислотами +1 -2 +1 +1 +6 -2 +1 +6 -2 +1 -2
- 16. Химические свойства оснований 3) Растворимые основания (щелочи) с кислотными оксидами +1 -2 +1 +6 -2 +1
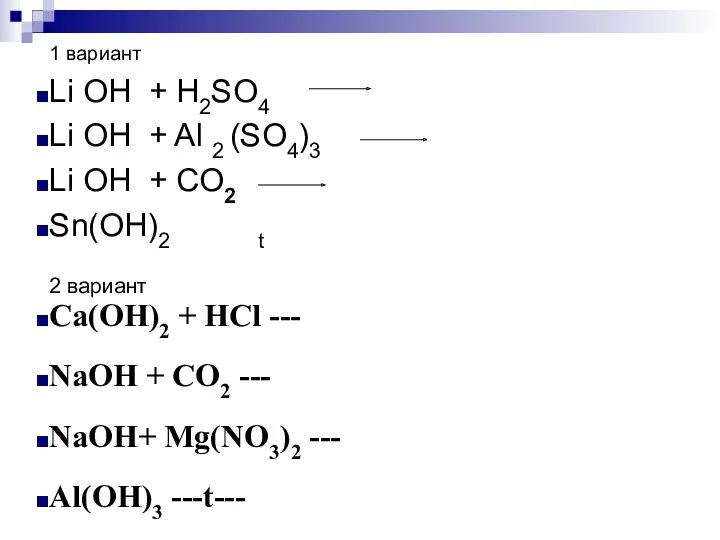
- 17. 1 вариант Li OH + H2SO4 Li OH + Al 2 (SO4)3 Li OH + CO2
- 18. Написать ионные уравнения: Ca(OH)2 + HCl --- NaOH + CO2 --- NaOH+ Mg(NO3)2 --- Al(OH)3 ---t---
- 19. Химическая свойства солей Вспомните, с какими веществами взаимодействуют соли? с металлами с кислотами с растворимыми основаниями
- 20. Химические свойства солей с металлами 0 +2 +6 -2 +2 +6 -2 0 Fe + CuSO4
- 21. Химические свойства солей 3) с растворимыми основаниями (щелочами) +2 -1 +1 -2 +1 +1 -1 +2
- 22. Химические свойства солей 5) с кислотными оксидами +2 +4 -2 +4 -2 t +2 +4 -2
- 23. Домашнее задание п. 7 задание 4,5 письменно
- 24. ГИА-9 (№22) Даны вещества: Mg, HNO3, Ba(NO3)2, HCl, AgNO3 . Используя воду и необходимые вещества только
- 25. Самопроверка 1) Mg + 2HCl = MgCl2 + H2↑ 2) MgCl2 + 2 AgNO3 = Mg(NO3)2
- 26. ГИА (№21) Какая масса осадка образуется при взаимодействии избытка раствора хлорида бария с 200 г раствора
- 27. Самопроверка Дано: mр-ра(Al2(SO4)3)= 200г ω (Al2(SO4)3) =10,4% m( BaSO4 ) - ? Решение: Al2(SO4)3 + 3BaCl2
- 28. Домашнее задание Повторить химические свойства неорганических соединений, §9, зад.6 Дополнительно для желающих (раздать карточки)
- 29. МОЛОДЦЫ! Вы успешно справились с работой!
- 30. Дополнительное д/з 1) Бесцветный прозрачный раствор способен изменить окраску фенолфталеина на малиновую. И пропускание через раствор
- 31. Дополнительное задание (ОГЭ-2020, №23) В трех колбах находятся растворы веществ: хлорида железа (II), хлорида магния и
- 33. Скачать презентацию

























 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН