Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром презентация
Содержание
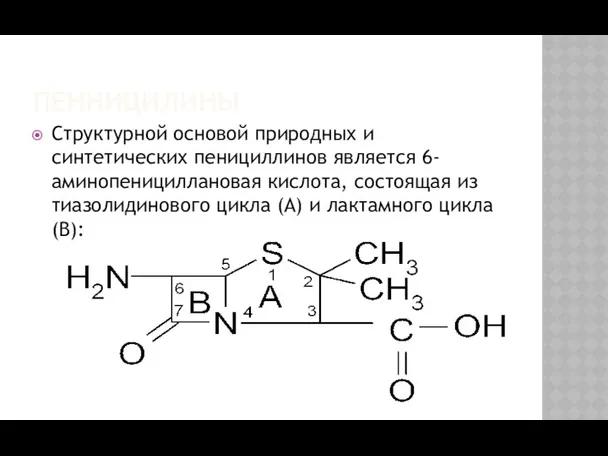
- 2. Структурной основой природных и синтетических пенициллинов является 6-аминопенициллановая кислота, состоящая из тиазолидинового цикла (А) и лактамного
- 3. ПЕННИЦИЛИНЫ Специфическая биологическая активность обусловлена наличием тиазолидинового и лактамного колец, а также заместителем в 6-ом положении.
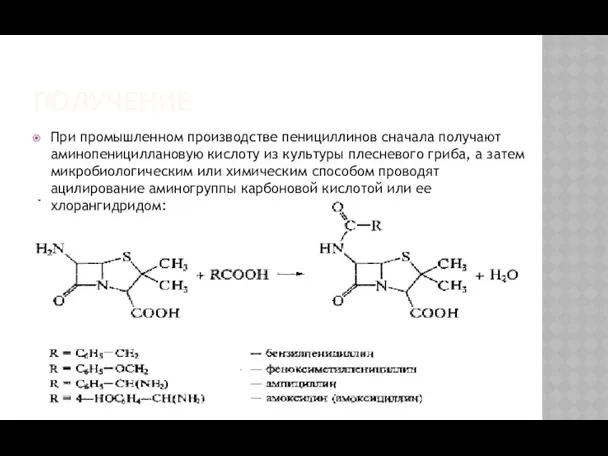
- 4. ПОЛУЧЕНИЕ При промышленном производстве пенициллинов сначала получают аминопенициллановую кислоту из культуры плесневого гриба, а затем микробиологическим
- 5. ПОЛУЧЕНИЕ На основе 6-АПК синтезировано большое количество полусинтетических пенициллинов, представляющих собой ацильные производные. В качестве ацилирующих
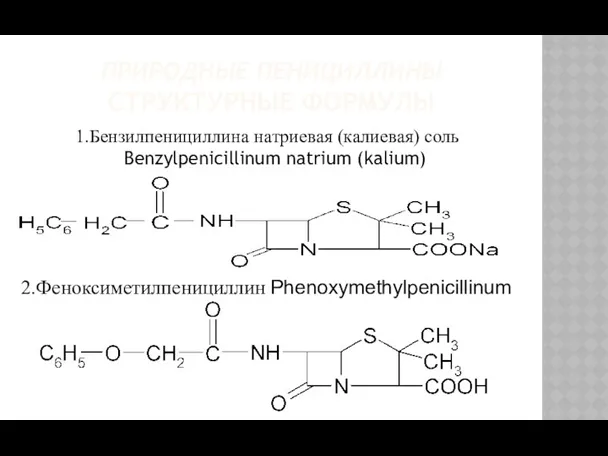
- 6. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ 1.Бензилпенициллина натриевая (калиевая) соль Benzylpenicillinum natrium (kalium) 2.Феноксиметилпенициллин Phenoxymethylpenicillinum
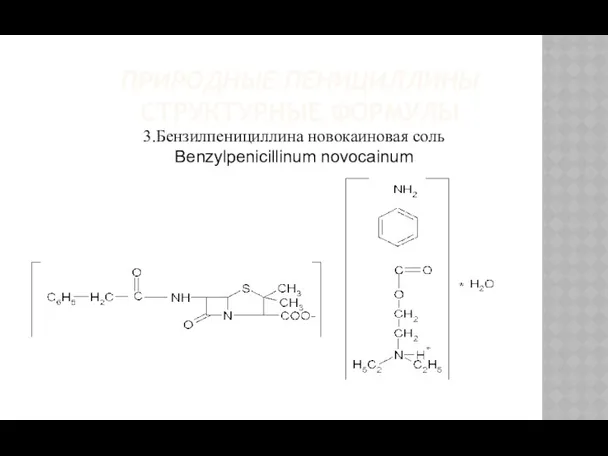
- 7. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ 3.Бензилпенициллина новокаиновая соль Benzylpenicillinum novocainum
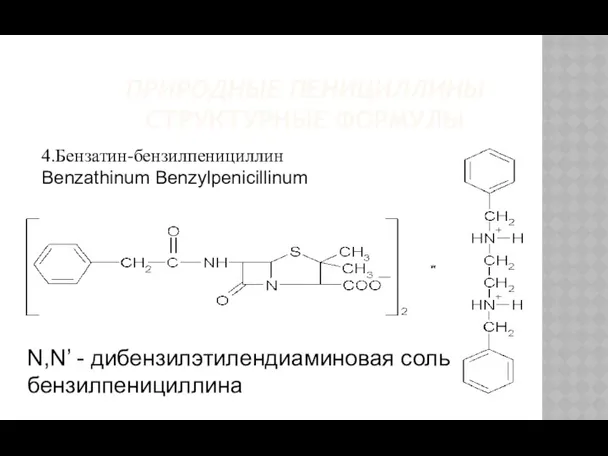
- 8. ПРИРОДНЫЕ ПЕНИЦИЛЛИНЫ СТРУКТУРНЫЕ ФОРМУЛЫ N,N’ - дибензилэтилендиаминовая соль бензилпенициллина 4.Бензатин-бензилпенициллин Benzathinum Benzylpenicillinum
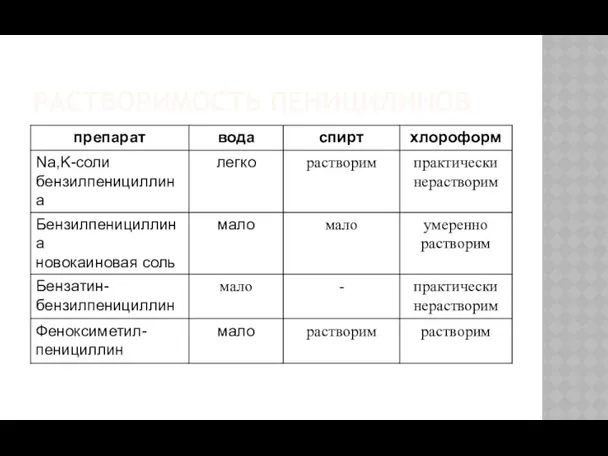
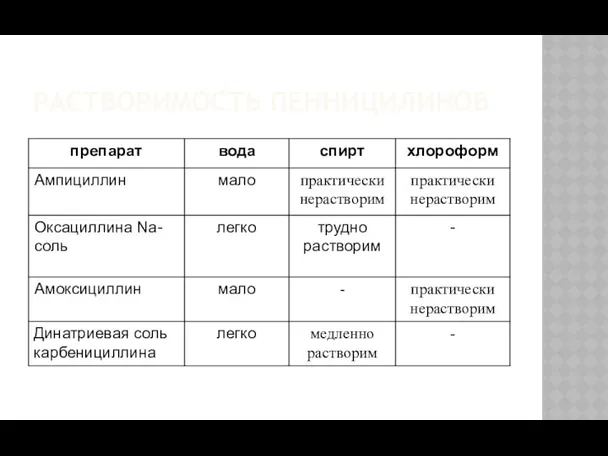
- 9. РАСТВОРИМОСТЬ ПЕНИЦИЛИНОВ
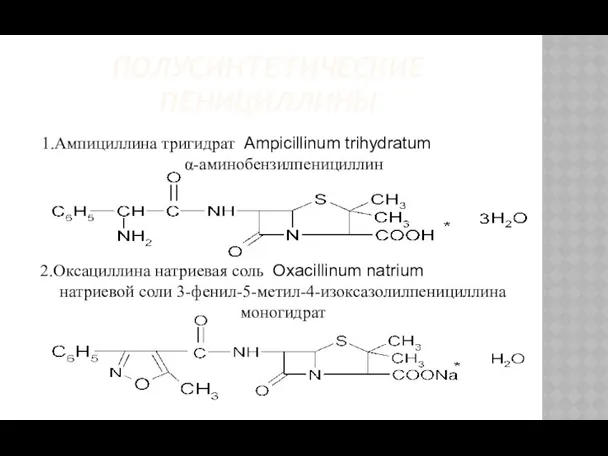
- 10. ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ 1.Ампициллина тригидрат Ampicillinum trihydratum α-аминобензилпенициллин 2.Оксациллина натриевая соль Oxacillinum natrium натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина моногидрат
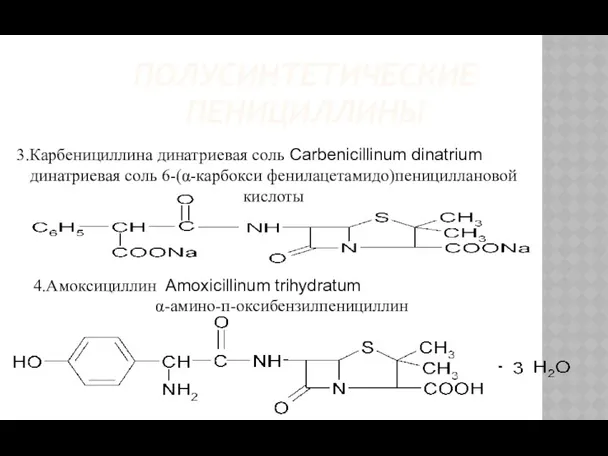
- 11. ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ 3.Карбенициллина динатриевая соль Carbenicillinum dinatrium динатриевая соль 6-(α-карбокси фенилацетамидо)пенициллановой кислоты 4.Амоксициллин Amoxicillinum trihydratum α-амино-п-оксибензилпенициллин
- 12. РАСТВОРИМОСТЬ ПЕННИЦИЛИНОВ
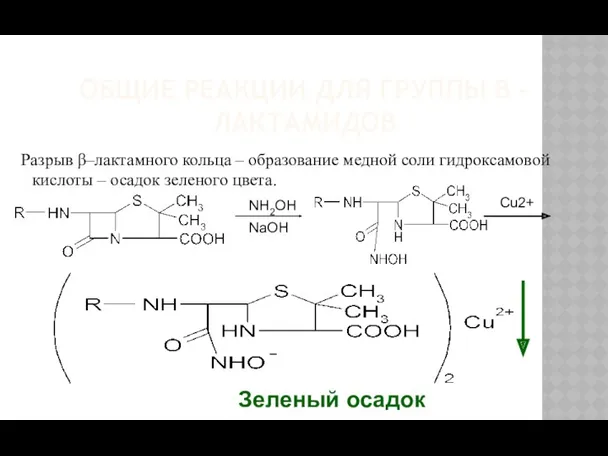
- 13. ОБЩИЕ РЕАКЦИИ ДЛЯ ГРУППЫ Β - ЛАКТАМИДОВ Разрыв β–лактамного кольца – образование медной соли гидроксамовой кислоты
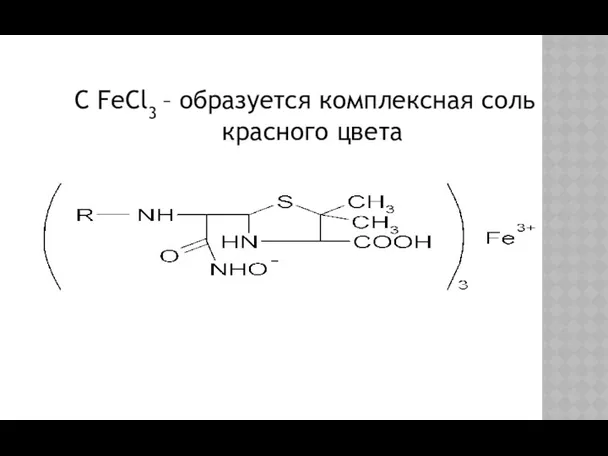
- 14. C FeCl3 – образуется комплексная соль красного цвета
- 15. ПРОБА ЛАССЕНЯ ДЛЯ ОБНАРУЖЕНИЯ N И S Препарат прокаливают с солями Na, фильтруют: а) к части
- 16. ОКИСЛИТЕЛЬНАЯ МИНЕРАЛИЗАЦИЯ а) сплавление со щелочью с образованием S2- иона: S2- + Pb2+ → PbS или
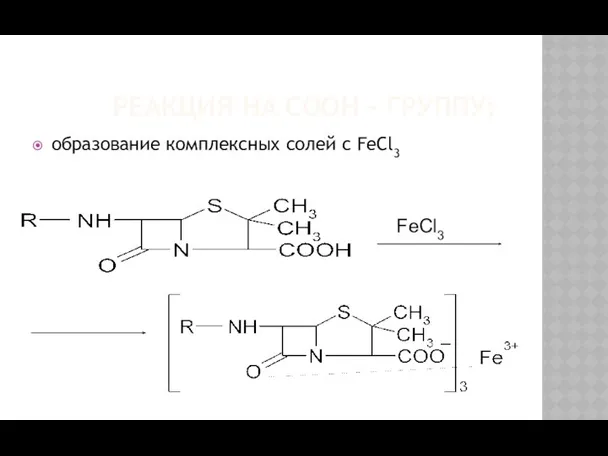
- 17. РЕАКЦИЯ НА СООН – ГРУППУ: образование комплексных солей с FeCl3 FeCl3
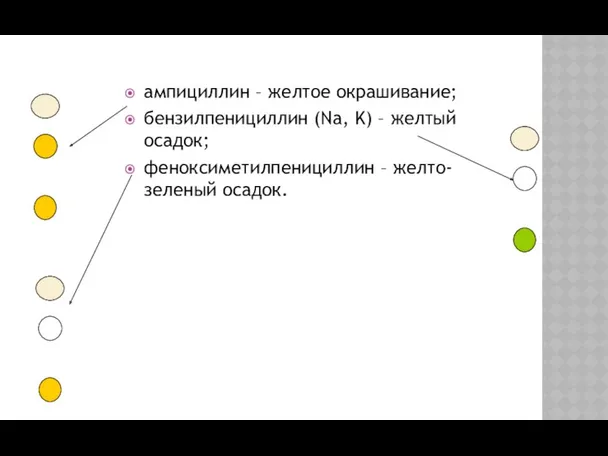
- 18. ампициллин – желтое окрашивание; бензилпенициллин (Na, K) – желтый осадок; феноксиметилпенициллин – желто-зеленый осадок.
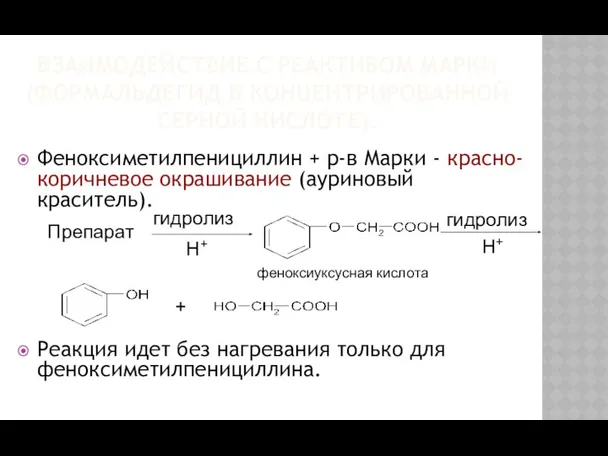
- 19. ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ). Феноксиметилпенициллин + р-в Марки - красно-коричневое окрашивание
- 20. ВЗАИМОДЕЙСТВИЕ С РЕАКТИВОМ МАРКИ (ФОРМАЛЬДЕГИД В КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ). Соли бензилпенициллина + р-в Марки - красно-коричневое
- 21. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ Состоит из двух этапов: определение суммы пенициллинов и определение соответствующего препарата. 1. Обратная йодометрия
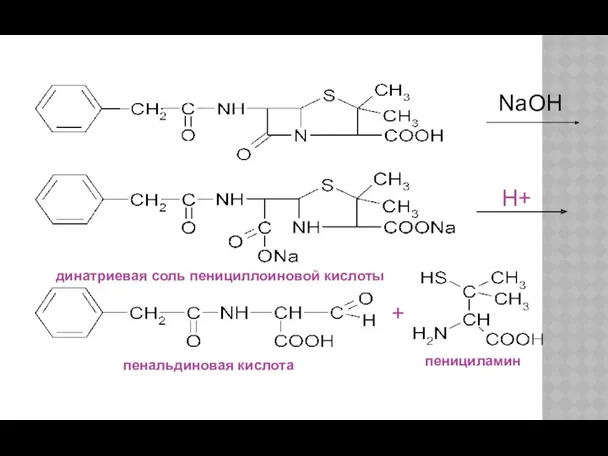
- 22. H+ пенициламин пенальдиновая кислота + динатриевая соль пенициллоиновой кислоты NaOH
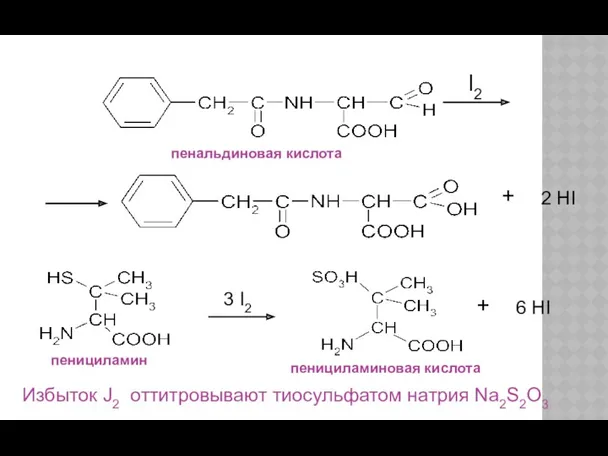
- 23. пенальдиновая кислота пенициламин пенициламиновая кислота Избыток J2 оттитровывают тиосульфатом натрия Na2S2O3 + I2 2 HI +
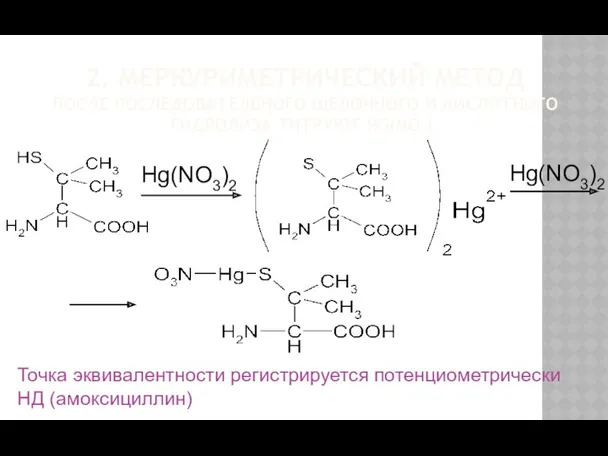
- 24. 2. МЕРКУРИМЕТРИЧЕСКИЙ МЕТОД ПОСЛЕ ПОСЛЕДОВАТЕЛЬНОГО ЩЕЛОЧНОГО И КИСЛОТНОГО ГИДРОЛИЗА ТИТРУЮТ HG(NO3)2 Точка эквивалентности регистрируется потенциометрически НД
- 25. Применение: антибактериальные препараты. Совместимость: пенициллины нельзя объединять с аминогликозидами в одном шприце, т.к. образующиеся пенициллоиновые кислоты
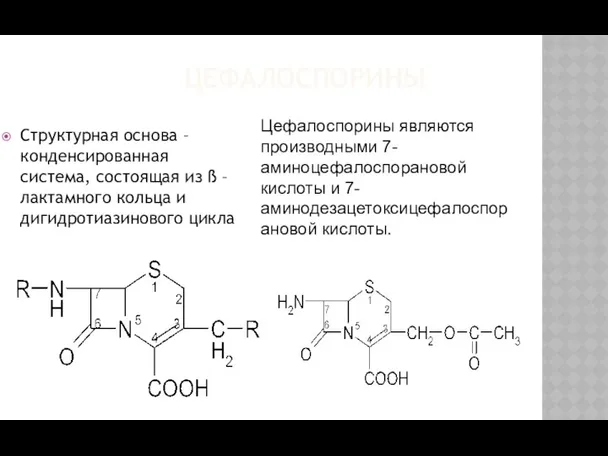
- 26. ЦЕФАЛОСПОРИНЫ Структурная основа – конденсированная система, состоящая из ß – лактамного кольца и дигидротиазинового цикла Цефалоспорины
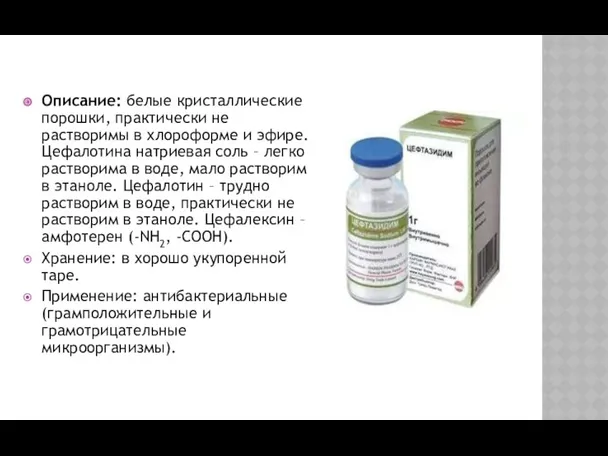
- 27. Описание: белые кристаллические порошки, практически не растворимы в хлороформе и эфире. Цефалотина натриевая соль – легко
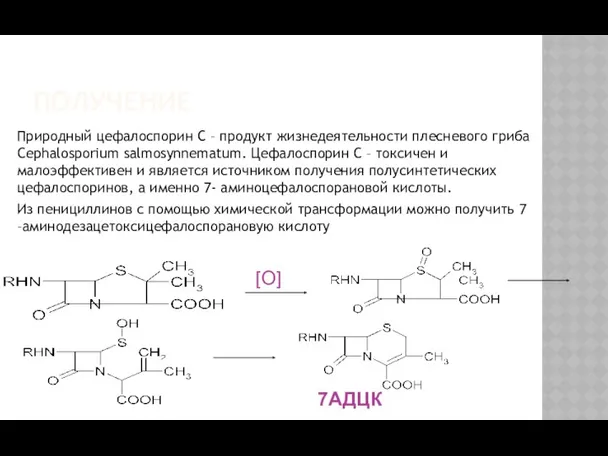
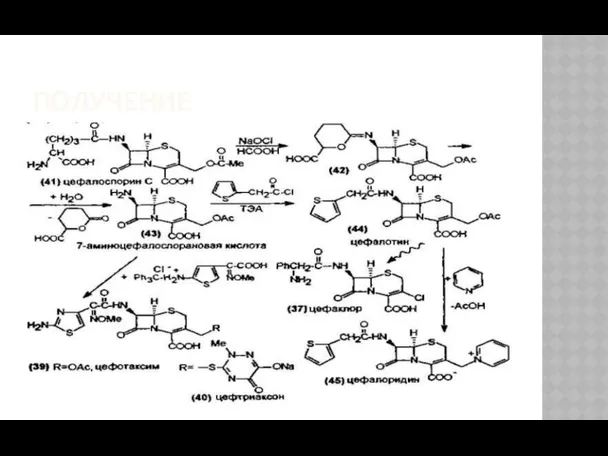
- 28. ПОЛУЧЕНИЕ Природный цефалоспорин С – продукт жизнедеятельности плесневого гриба Cephalosporium salmosynnematum. Цефалоспорин С – токсичен и
- 29. ПОЛУЧЕНИЕ Антибиотики цефалоспориновой группы син-тезируются на основе цефалоспорина С , получаемого ферментативным путем. В отличие от
- 30. ПОЛУЧЕНИЕ
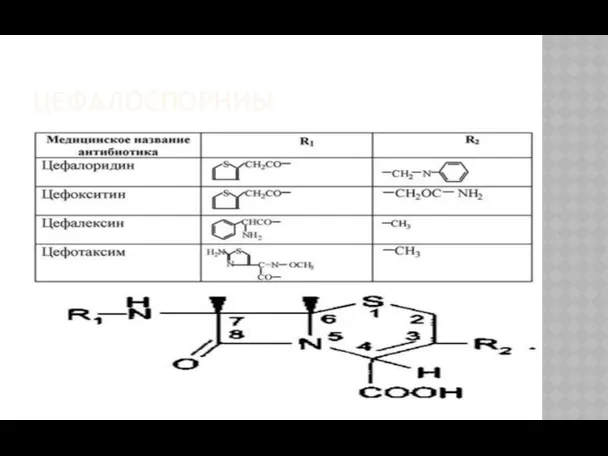
- 31. ЦЕФАЛОСПОРНИЫ
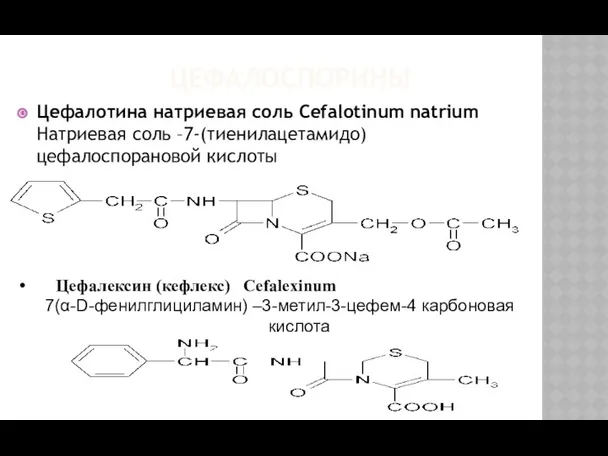
- 32. ЦЕФАЛОСПОРИНЫ Цефалотина натриевая соль Cefalotinum natrium Натриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты Цефалексин (кефлекс) Cefalexinum 7(α-D-фенилглициламин) –3-метил-3-цефем-4
- 33. 1.Цефалексин - на аминокислоту: нингидриновая проба и реакция комплексообразования с ионами Cu2+ в среде уксусной кислоты
- 35. Скачать презентацию









 Химические свойства соляной кислоты
Химические свойства соляной кислоты Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Химия и сельское хозяйство
Химия и сельское хозяйство Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Методи очищення води в побуті
Методи очищення води в побуті Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Химиялық элементтердің табиғи топтары
Химиялық элементтердің табиғи топтары Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) Комплексные соединения. Природа химической связи: метод молекулярных орбиталей
Комплексные соединения. Природа химической связи: метод молекулярных орбиталей Значення періодичного закону
Значення періодичного закону яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Производство азотной кислоты
Производство азотной кислоты Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Вирощування кристалів солей
Вирощування кристалів солей Сучасні матеріали. Пластмаса
Сучасні матеріали. Пластмаса Elements of group 2 (IIA)
Elements of group 2 (IIA) Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов Electron Structure
Electron Structure Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Игра - викторина
Игра - викторина Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5
Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5 Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2