Содержание
- 2. План лекції 1. Теорії, що пояснюють процес само-спалахування 2. Температура самоспалахування речовин. Фактори, що впливають на
- 3. 1. ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕС САМОСПАЛАХУВАННЯ Самоспалахування – виникнення горіння внаслідок різкого збільшення швидкості екзотермічних реакцій
- 4. 1.1. Теплова теорія самоспалахування За тепловою теорією умовою виникнення горіння є досягнення критичної температури в системі,
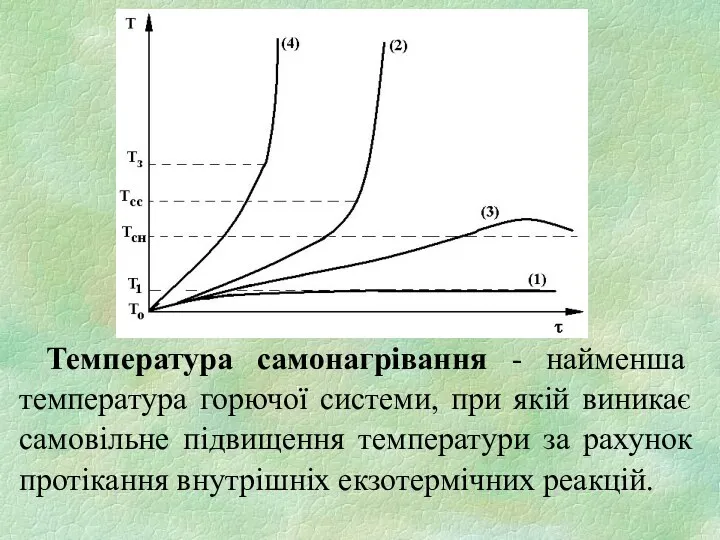
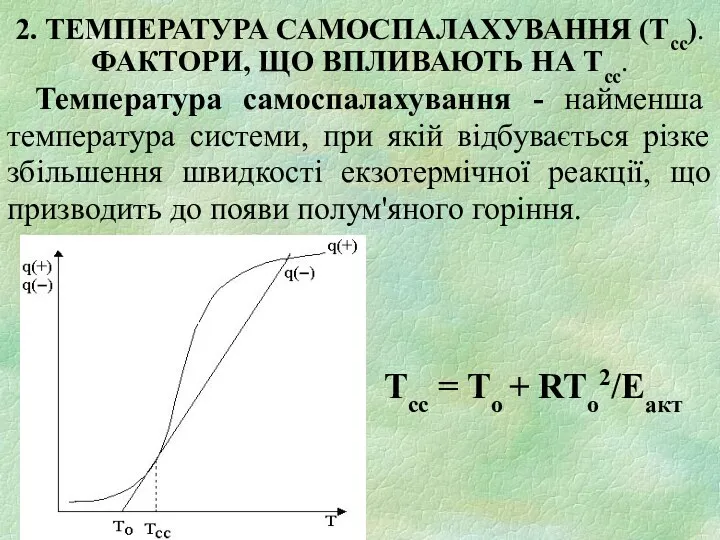
- 5. Температура самонагрівання - найменша температура горючої системи, при якій виникає самовільне підвищення температури за рахунок протікання
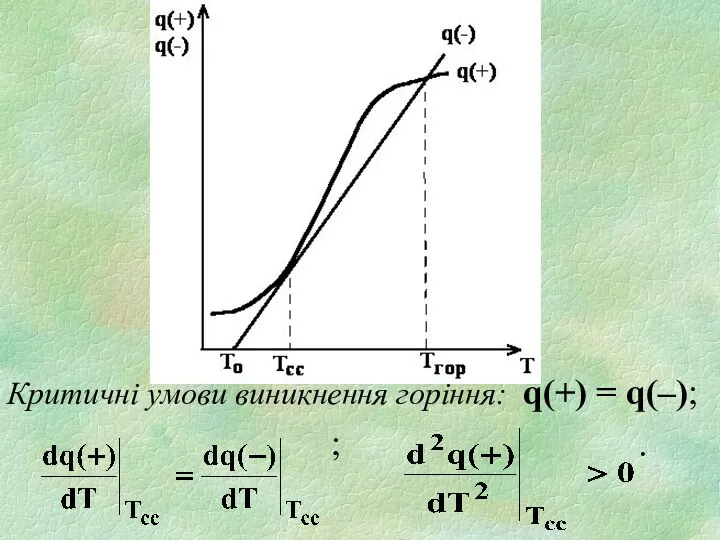
- 6. Інтенсивність тепловиділення: Графік зміни швидкості тепловиділення q(+) з температурою відображається експоненційною кривою. Інтенсивність тепловіддачі: q(-) =
- 7. Критичні умови виникнення горіння: q(+) = q(–); ; .
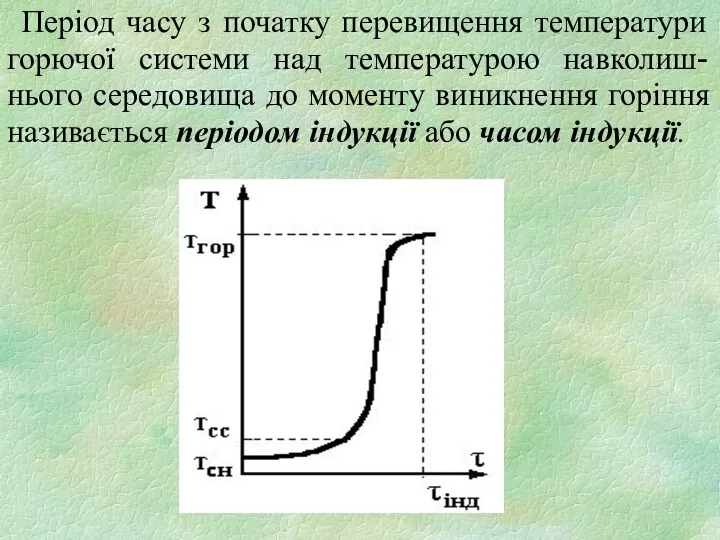
- 8. Період часу з початку перевищення температури горючої системи над температурою навколиш-нього середовища до моменту виникнення горіння
- 9. 1.2. Ланцюгова теорія самоспалахування За ланцюговою теорією виникнення горіння (тобто різке збільшення швидкості реакції окислення) є
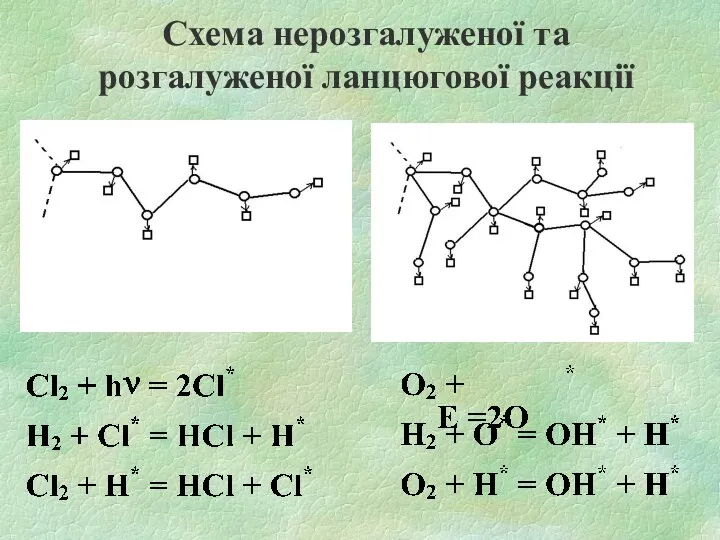
- 10. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ Зародження (ініціювання) ланцюгів - стадія ланцюгової реакції, в якій утворюються вільні радикали з
- 11. Розгалуження ланцюгів - стадія ланцюгового процесу, у якій перетворення активних проміжних продуктів реакції призводить до збільшення
- 12. Схема нерозгалуженої та розгалуженої ланцюгової реакції
- 13. Швидкість ланцюгової реакції: де n – концентрація активних центрів, ωо - швидкість початкового ініціювання (утворення) АЦ,
- 14. 2. ТЕМПЕРАТУРА САМОСПАЛАХУВАННЯ (Тсс). ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА Тсс. Температура самоспалахування - найменша температура системи, при
- 15. На Tсс речовин впливають три групи факторів: 1) вид горючої речовини середня довжина вуглецевого ланцюга lсер;
- 16. 2.1. Хімічна будова горючої речовини При збільшенні енергії розриву зв'язку реакція окислення, а отже й процес
- 18. 2.2. Склад горючої суміші Концентрація горючої речовини q(+)=QнVгсwхр Найбільша швидкість хімічної реакції, а отже і тепловиділення
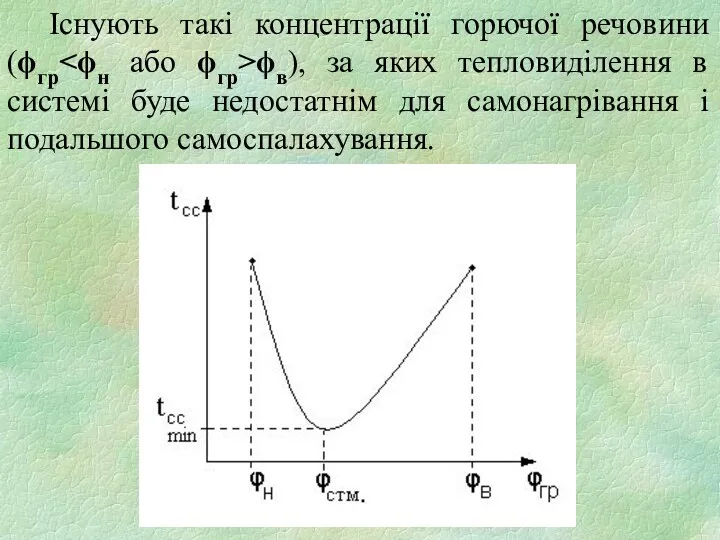
- 19. Існують такі концентрації горючої речовини (ϕгр ϕв), за яких тепловиділення в системі буде недостатнім для самонагрівання
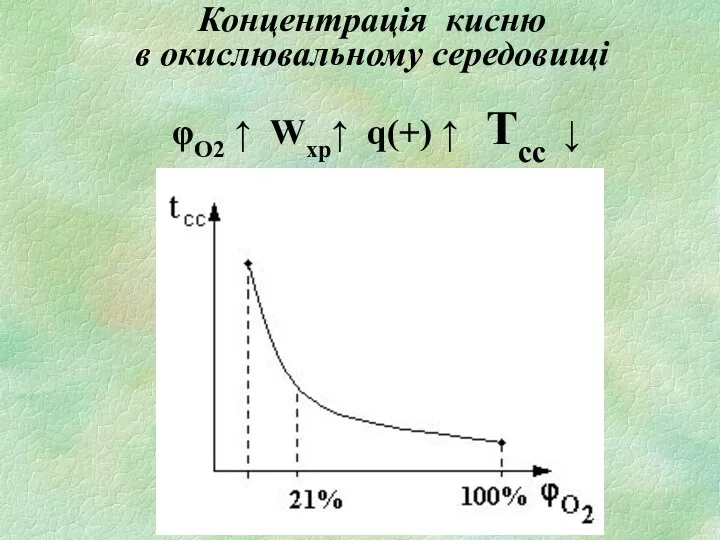
- 20. Концентрація кисню в окислювальному середовищі φО2 ↑ Wхр↑ q(+) ↑ Tсс ↓
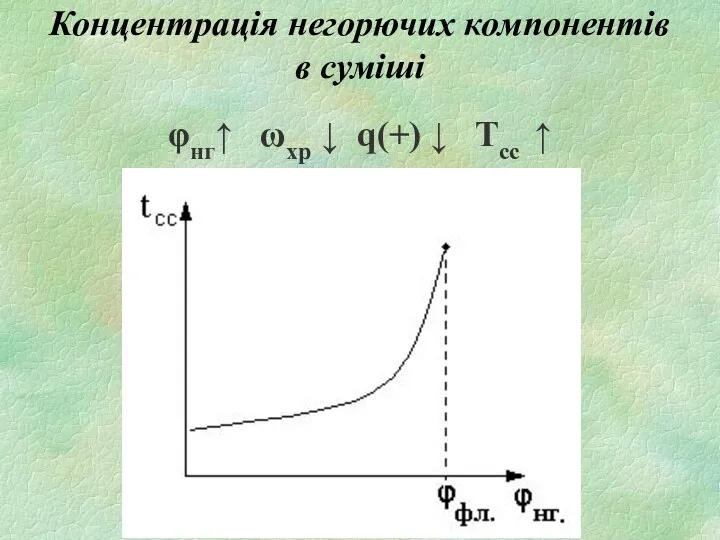
- 21. Концентрація негорючих компонентів в суміші φнг↑ ωхр ↓ q(+) ↓ Tсс ↑
- 22. 2.3. Умови, в яких знаходиться система Об'єм і діаметр посудини. q(+) = QнVгсwхр q(-) = α
- 23. 3. ВИЗНАЧЕННЯ Тсс Експериментальні методи 1) метод впускання заздалегідь готової холодної суміші у вакуумовану нагріту посудину;
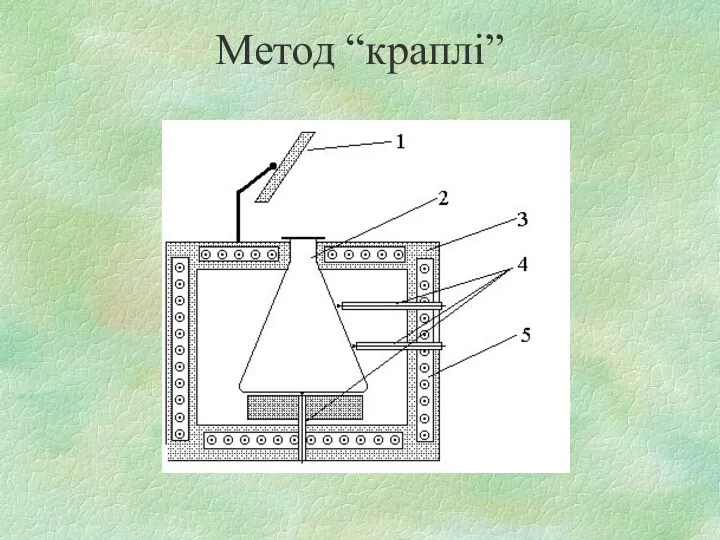
- 24. Метод “краплі”
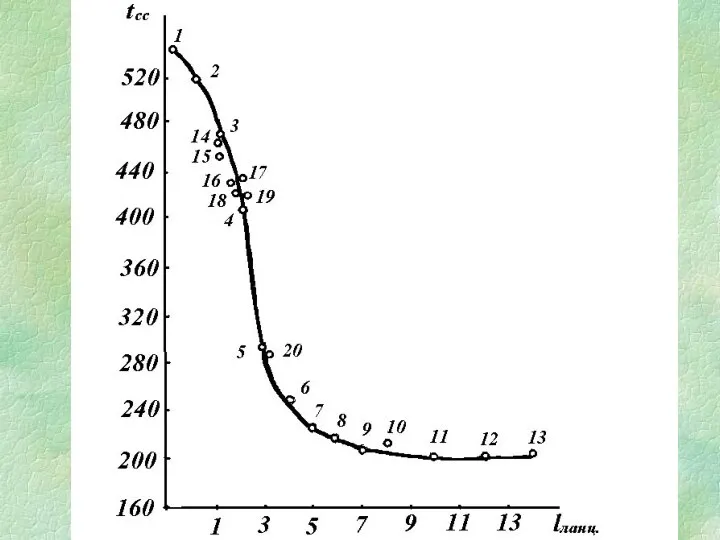
- 25. Розрахункове визначення Tсс при lcеp ≤ 5 при lcеp ≥ 5 Ланцюг - безперервна послідовність пов'язаних
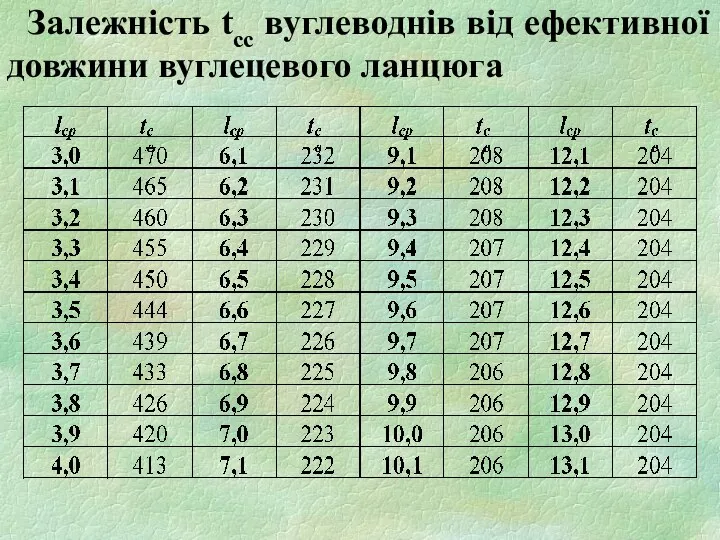
- 26. Залежність tсс вуглеводнів від ефективної довжини вуглецевого ланцюга
- 27. Температуру самоспалахування інших класів органічних сполук можна розрахувати за формулою: tсс = а⋅tссалк + b де
- 28. 4. Практичне значення температури самоспалахування Тсс використовують для оцінки пожежної небезпеки речовин Чим нижче температура самоспалахування
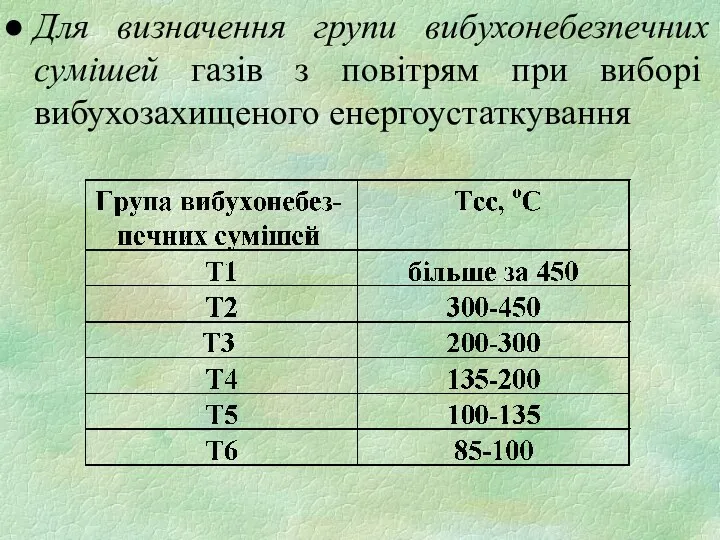
- 29. Для визначення групи вибухонебезпечних сумішей газів з повітрям при виборі вибухозахищеного енергоустаткування
- 31. Скачать презентацию
















 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Электролиз
Электролиз Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Вольтамперометрические методы анализа
Вольтамперометрические методы анализа Ископаемые углеводороды
Ископаемые углеводороды Минералогический состав почв
Минералогический состав почв Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 IV группа главная подгруппа
IV группа главная подгруппа Омыватель лобового стекла автомобиля
Омыватель лобового стекла автомобиля Реактор получения элементарной серы
Реактор получения элементарной серы Введение в химию. 8 класс
Введение в химию. 8 класс Щелочные металлы
Щелочные металлы От алхимии к химии
От алхимии к химии 5-я группа элементов
5-я группа элементов Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Основные виды сырья для производства строительных материалов. Лекция 4
Основные виды сырья для производства строительных материалов. Лекция 4 Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Углерод. Элемент IV группы
Углерод. Элемент IV группы Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Соединения железа
Соединения железа Кремний и его соединения
Кремний и его соединения Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Роль хімії в природі
Роль хімії в природі Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Химические соединения в организме человека
Химические соединения в организме человека 20230419_eds
20230419_eds