Содержание
- 2. Гидролиз – процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
- 3. Степень гидролиза соли определяется следующими факторами: 1.Так как гидролиз - процесс эндотермический, то повышение температуры усиливает
- 4. Также количественной характеристикой гидролиза может служить константа гидролиза. Константа гидролиза (Кг) и степень гидролиза (h) связаны
- 5. Аналогично для солей, образованных сильной кислотой и слабым основанием (учитывается Косн.). Любую соль можно представить как
- 6. Рассмотрим важнейшие случаи гидролиза солей: 1. Соль образована сильным основанием или слабой кислотой Эти соли образованы
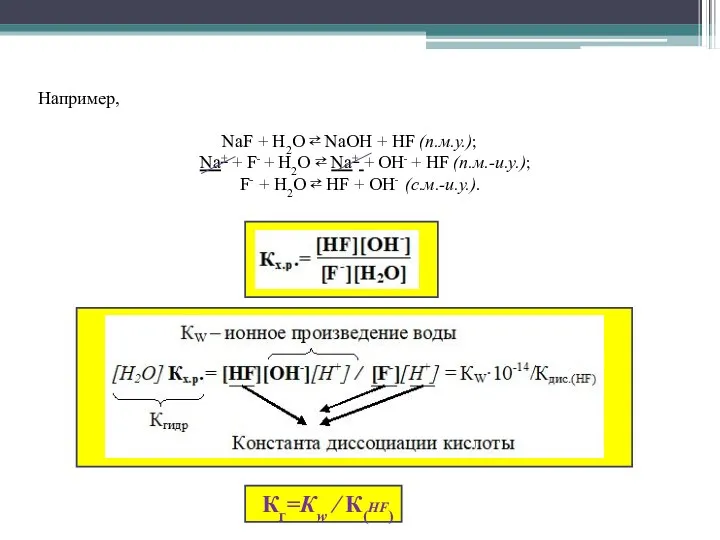
- 7. Константа гидролиза соли сильного основания и слабой кислоты рассчитывается по формуле Кг=Кw ∕ Ккисл, где Кw
- 8. Например, NaF + Н2О ⇄ NaОН + НF (п.м.у.); Na+ + F- + Н2О ⇄ Na+
- 9. 2. Соль образована слабым основанием и сильной кислотой. Например, NH₄Cl, AlCl₃, CuSO₄ и др. В этом
- 10. Константа гидролиза соли сильной кислоты и слабого основания рассчитывается по формуле Кг = Кw ∕ Косн,
- 11. 3. Соль образована слабым основанием и слабой кислотой (CH₃COONH₄, (NH4)2SiO3). Эти соли образованы катионом слабого основания
- 12. Константа гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты: Кг = [Кв /(Ккисл∙Косн)]. Расчет рН
- 13. 4. Соли, образованные сильными основаниями и сильными кислотами (NаСl, КNO3, Rb2SO4), не содержат ионов, способных к
- 14. Полный гидролиз происходит также при совместном присутствии в водном растворе двух типов солей (соли, образованной слабым
- 15. Гидролиз по многозарядному катиону. Соль диссоциирует в растворе на ионы CuSO₄ = Cu²⁺ + SO₄²⁻. Первая
- 16. Гидролиз по многозарядному аниону Соль диссоциирует в растворе на ионы Na₃PO₄ = 3Na⁺ + PO₄³⁻. Первая
- 18. Скачать презентацию














 Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Кремний және оның қосылыстары
Кремний және оның қосылыстары Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Неметаллы. 11 класс
Неметаллы. 11 класс Seminar on kesterites
Seminar on kesterites Electrochemistry
Electrochemistry Исследование родника. Химические и физические свойства воды
Исследование родника. Химические и физические свойства воды Химикаты для сельского хозяйства
Химикаты для сельского хозяйства Камни и Скорпион
Камни и Скорпион Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Оксиды серы (IV) и (VI). Серная кислота, физические и химические свойства
Оксиды серы (IV) и (VI). Серная кислота, физические и химические свойства Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах
Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах Атом. Модели строения атома
Атом. Модели строения атома Металлы главных подгрупп
Металлы главных подгрупп Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Спирты. Классификация спиртов
Спирты. Классификация спиртов