Содержание
- 2. Удивить готов он нас - Он и уголь, и алмаз, Он в карандашах сидит, Потому что
- 3. НЕМЕТАЛЛЫ - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего уровня.
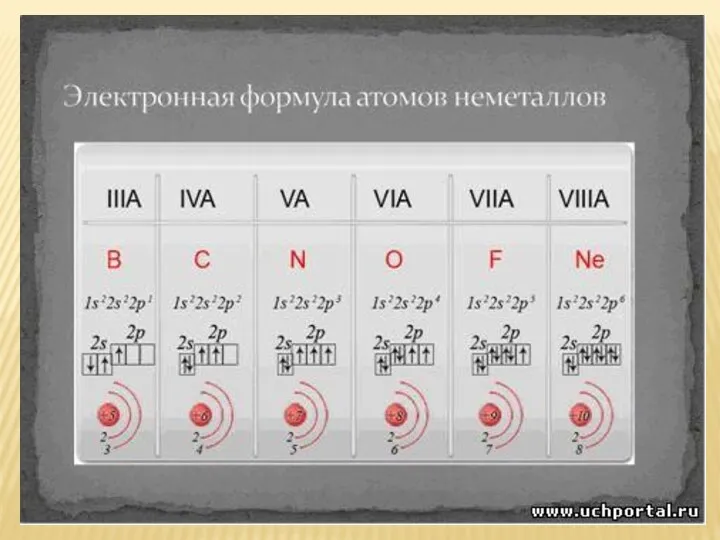
- 4. Положение неметаллов в периодической системе химических элементов Немета́ллы — химические элементы с типично неметаллическими свойствами, которые
- 5. Кроме того, к неметаллам относят также водород и гелий. Характерной особенностью неметаллов является большее (по сравнению
- 7. ЗАДАНИЕ: Напишите электронные формулы - серы, фтора, мышьяка, брома S 1s²2s²2p⁶3s²3p⁴ F 1s²2s²2p⁵ As 1s²2s²2p⁶3s²3p⁶4s²4p³ Br
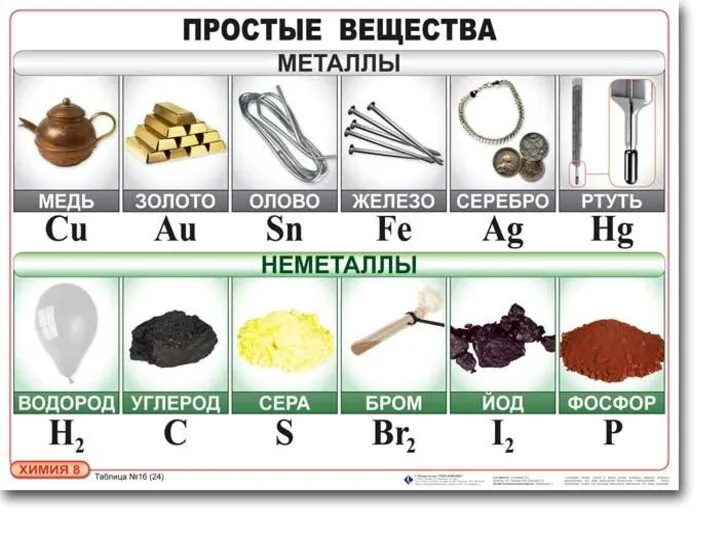
- 8. НАХОЖДЕНИЕ НЕМЕТАЛЛОВ В ПРИРОДЕ В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор,
- 10. Чаще неметаллы находятся в химически связанном виде: вода, минералы, горные породы, различные силикаты, фосфаты, сульфиды. силикат
- 11. фосфат кальция
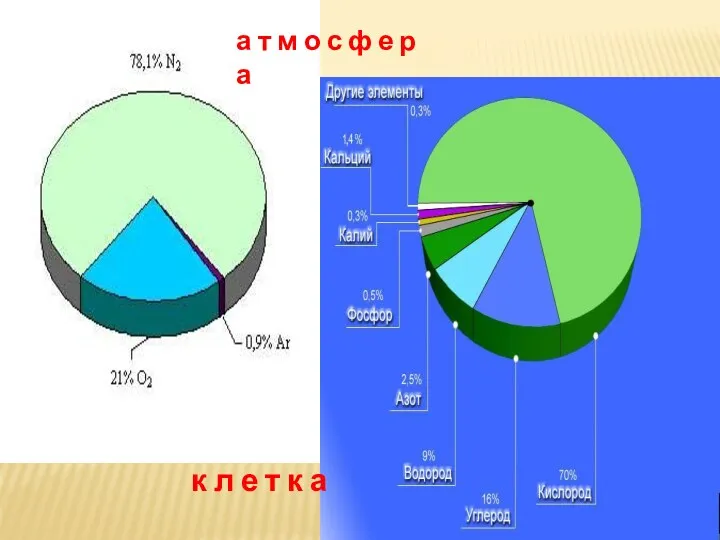
- 12. а т м о с ф е р а к л е т к а
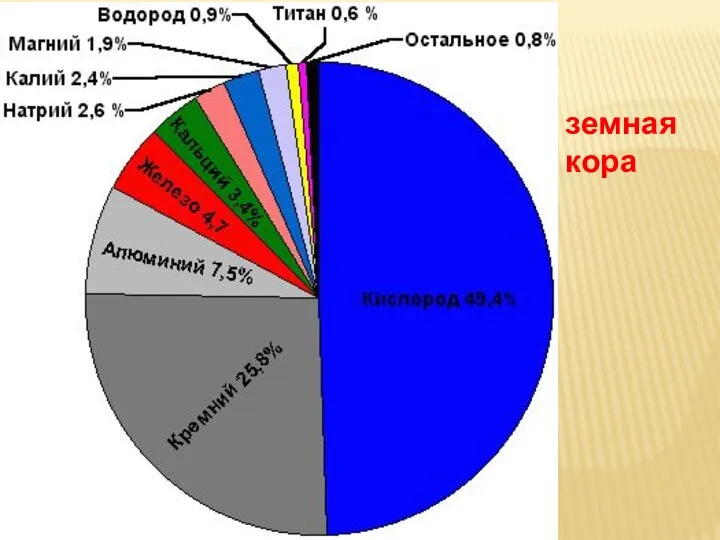
- 13. земная кора
- 14. ЗАДАНИЕ: Какого газа ( по объему) больше всего в атмосфере Земли ? А З О Т
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ ПРОСТЫЕ ВЕЩЕСТВА – атомы в молекуле связаны ковалентной неполярной связью. СТРОЕНИЕ: Молекулярное -
- 16. С Е Р А КРАСНЫЙ ФОСФОР БЕЛЫЙ ФОСФОР
- 17. КРЕМНИЙ СЕЛЕН
- 18. У некоторых неметаллов наблюдается проявление аллотропии: - для газообразного кислорода характерны две аллотропных модификации — кислород
- 19. Гость из космоса пришел, в воздухе приют себе нашел. ВОДОРОД 2.В доме выше всех живем, вдвоем
- 20. 10.Какой неметалл является лесом? БОР 11.Какие химические элементы утверждают, что могут другие вещества рождать? ВОДОРОД, КИСЛОРОД,
- 21. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Окислительные свойства простых веществ: Реагируют с металлами 2K + S⁰ = K₂S⁻² 3Ca
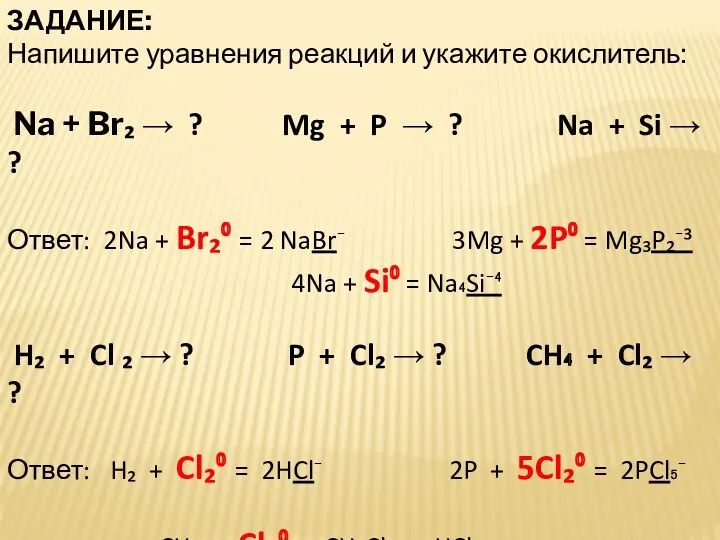
- 22. ЗАДАНИЕ: Напишите уравнения реакций и укажите окислитель: Na + Br₂ → ? Mg + P →
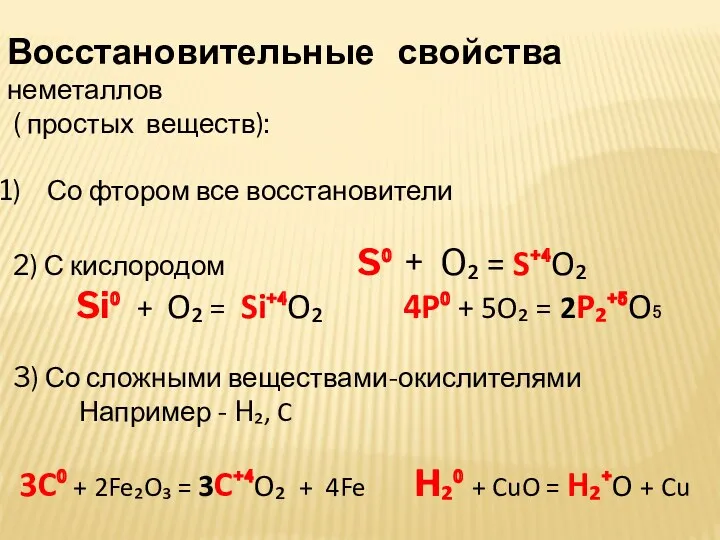
- 23. Восстановительные свойства неметаллов ( простых веществ): Со фтором все восстановители 2) С кислородом S⁰ + O₂
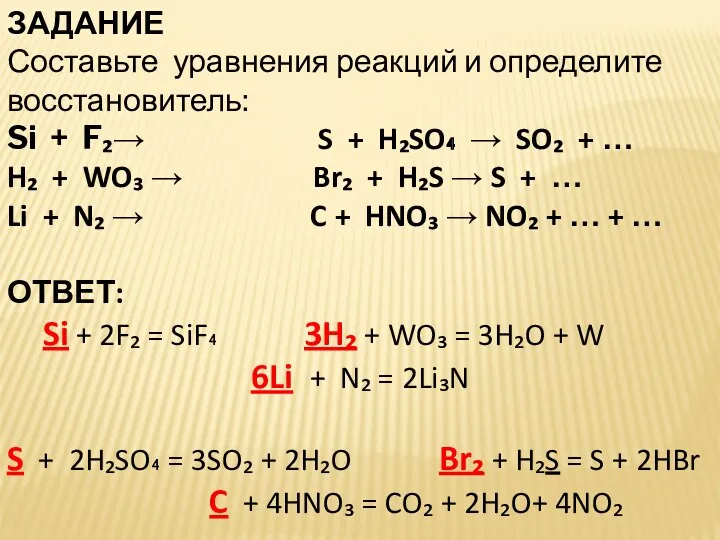
- 24. ЗАДАНИЕ Составьте уравнения реакций и определите восстановитель: Si + F₂→ S + H₂SO₄ → SO₂ +
- 25. ПОЛУЧЕНИЕ НЕМЕТАЛЛОВ в промышленности
- 26. Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот:
- 27. Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600
- 28. Хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
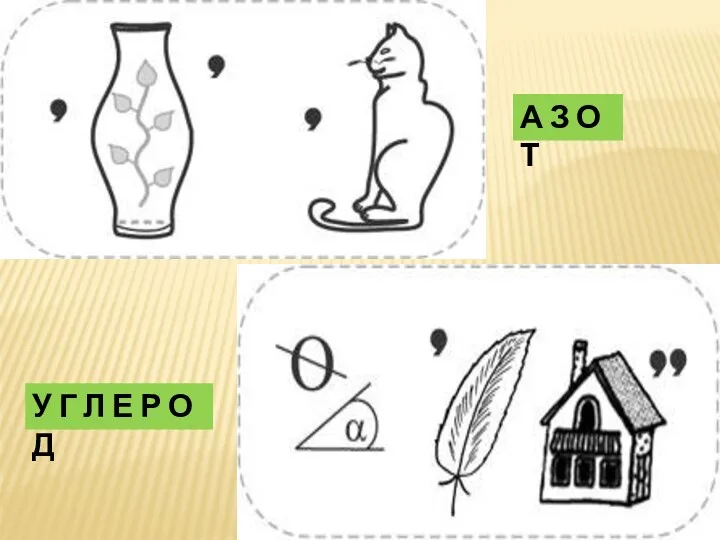
- 29. Р Е Б У С Ы Й О Д К Р Е М Н И Й
- 30. А З О Т У Г Л Е Р О Д
- 31. 1. Неметаллы, расположенные в порядке усиления их неметалличности, - это 1) азот, углерод, бор 3) фтор,
- 32. 5. Верны ли следующие суждения о неметаллах и их соединениях: А. Низшая степень окисления азота и
- 34. Скачать презентацию






















 Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10 Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях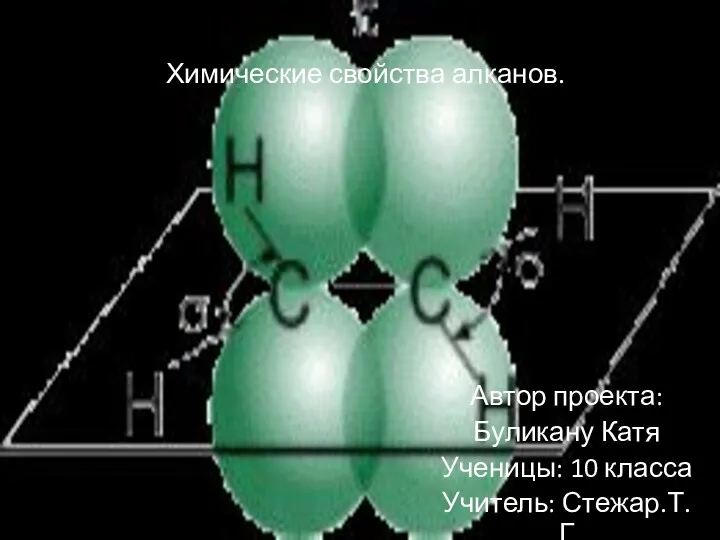 Химические свойства алканов
Химические свойства алканов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электронное строение атома
Электронное строение атома Белки. Строение
Белки. Строение Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Катионы І - ІІІ аналитических групп
Катионы І - ІІІ аналитических групп Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Минералы и горные породы
Минералы и горные породы Общая характеристика неметаллов
Общая характеристика неметаллов Методика обучения и воспитания на уроках химии
Методика обучения и воспитания на уроках химии Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты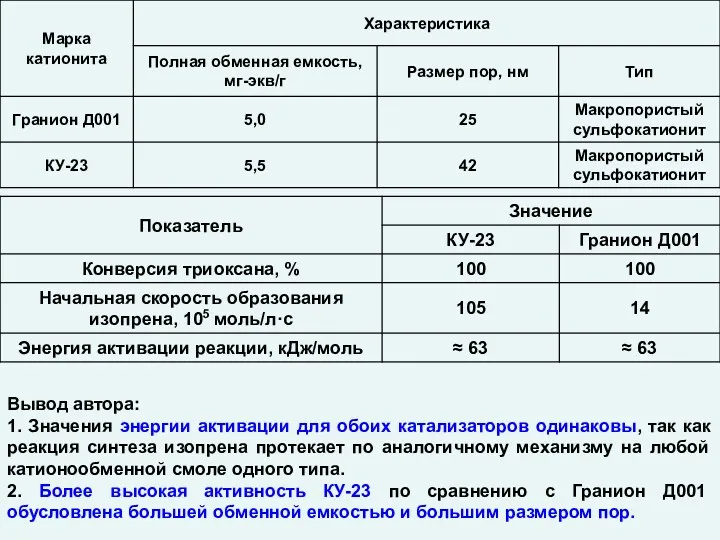 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Основы термодинамики
Основы термодинамики Химическая связь. 8 класс
Химическая связь. 8 класс Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества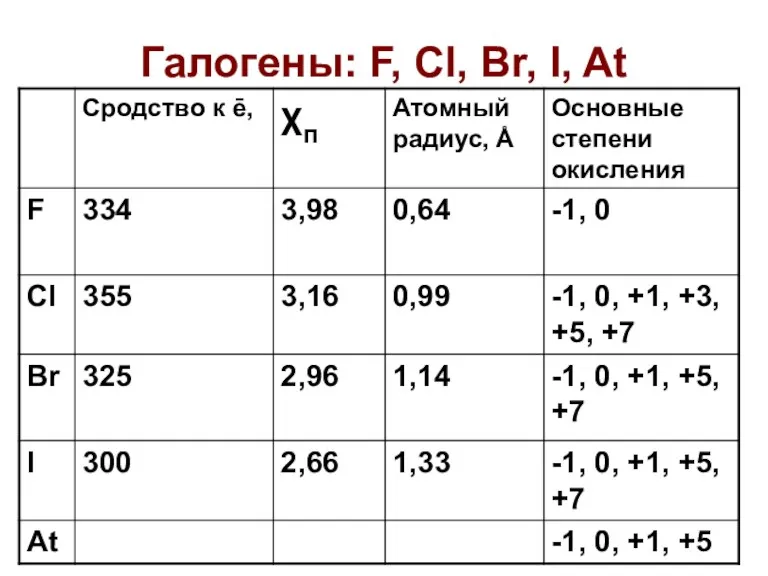 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Оксиды. Физические свойства
Оксиды. Физические свойства Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства алканов
Химические свойства алканов Гипергенез и почвообразование
Гипергенез и почвообразование