Содержание
- 2. Гипергенез Процесс разрушения горных пород на поверхности Земли под влиянием воды, воздуха, колебаний температуры и жизнедеятельности
- 3. Гипергенез Физическое выветривание приводит к чисто механическому разрушению пород. Колебания температуры, морозное выветривание и солевое растрескивание
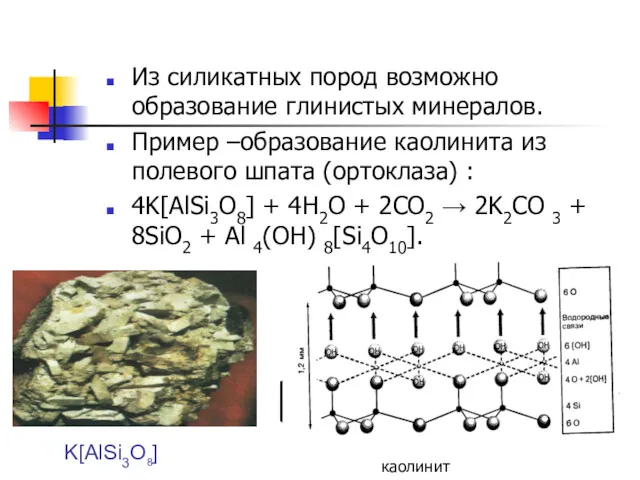
- 4. Из силикатных пород возможно образование глинистых минералов. Пример –образование каолинита из полевого шпата (ортоклаза) : 4K[AlSi3O8]
- 5. Факторы, влияющие на скорость гипергенеза рельеф местности, климат (осадки, температура), состав воды, тип материнской породы, кинетика
- 7. Температура Скорость выветривания (гипергенеза) за счет температуры в тропиках (среднегодовая 20 °С) будет примерно в 4–6
- 8. Водный режим недостаток воды (как реагента); образование корочки эвапоритных минералов, карбонатов, гипса, образующихся на поверхности низкая
- 9. Тип горной породы. Ряд силикатов (S) «кварц (каркасный S) → слюда мусковит (слоистый S) → слюда
- 10. Механизмы химического выветривания Простейшая реакция выветривания — это растворение минералов. NaCl(тв) + Н2О → Na+ +
- 11. Окислительно-восстановительные реакции С участием свободного кислорода 2FeS 2(тв) + 7,5O 2 + 7Н 2 О →
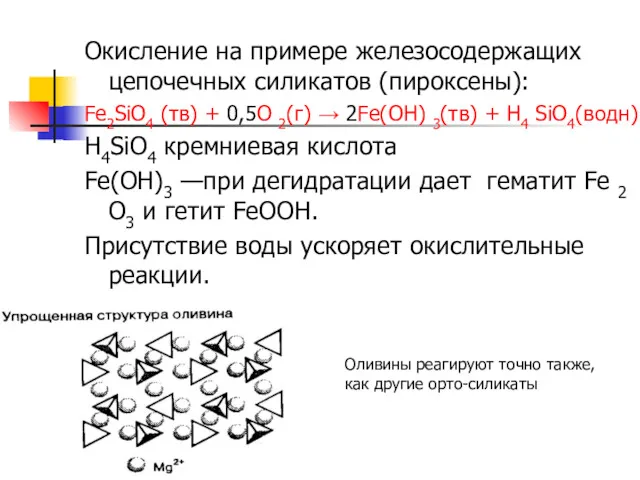
- 12. Окисление на примере железосодержащих цепочечных силикатов (пироксены): Fe2SiO4 (тв) + 0,5O 2(г) → 2Fe(OH) 3(тв) +
- 13. Органическое вещество почв также окисляется (микроорганизмы). Важный процесс с точки зрения усиления кислотности почв ( от
- 14. Кислотный гидролиз Реакцию между минералом и кислыми агентами выветривания обычно называют кислотным гидролизом. Избыток СО2 способствует
- 16. Кислотный гидролиз оливина Кислотный гидролиз приводит к тому, что поверхностные воды имеют нейтральную реакцию и преобладающим
- 18. Скачать презентацию













 Количество вещества. Моль
Количество вещества. Моль Основы органической химии
Основы органической химии Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Кремний. Применение кремния
Кремний. Применение кремния Титанның химиялық элементі
Титанның химиялық элементі Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Химиядан сұрақтар
Химиядан сұрақтар Кислород. Атом кислорода
Кислород. Атом кислорода Природные источники углеводородов
Природные источники углеводородов Қатты күйдегі препараттар
Қатты күйдегі препараттар Радиусы атомов и ионов
Радиусы атомов и ионов Теорія горіння та вибуху
Теорія горіння та вибуху Химия. Изучение жиров
Химия. Изучение жиров Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Solutions and solubilities
Solutions and solubilities Хімічні сполуки у побуті
Хімічні сполуки у побуті Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Кислородсодержащие органические соединения. Спирты. 10 класс
Кислородсодержащие органические соединения. Спирты. 10 класс Химическая связь
Химическая связь Как и где используется соляная кислота
Как и где используется соляная кислота Виды химической связи
Виды химической связи Вода. Растворимость, растворы
Вода. Растворимость, растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Обмоточные провода
Обмоточные провода Классификация химических реакций
Классификация химических реакций