Содержание
- 2. Взаимное влияние атомов Взаимное влияние атомов в молекуле, ионе, радикале осуществляется под влиянием электронных и пространственных
- 3. Заместители - 04.03.2016 любой атом (кроме водорода), который непосредственно не участвует в реакции, но оказывает влияние
- 4. Электронные эффекты 04.03.2016 Смещение электронной плотности в молекуле, ионе, радикале под влияние заместителей, подразделяются на: -
- 5. Электронодонорные заместители атомная группировка (или атом), повышающая электронную плотность на остальной части молекулы 04.03.2016
- 6. Электроноакцепторные заместители атомная группировка (или атом), понижающая электронную плотность на связанном с ним углеводородном фрагменте 04.03.2016
- 7. Электроноакцепторные заместители Два вида влияний заместителей: индуктивный эффект (±I); мезомерный эффект (±M). В зависимости от смещения
- 8. Индуктивный эффект Передача по цепи сигма-связей электронного влияния заместителей, которое обусловлено различиями в электроотрицательности атомов 04.03.2016
- 9. Индуктивный эффект Направление смещения электронной плотности σ-связей обозначается стрелками и символами частичных зарядов (δ+ или δ-)
- 10. Индуктивный эффект Из-за слабой поляризуемости σ-связей I-эффект быстро ослабевает с удалением заместителя и через 3-4 связи
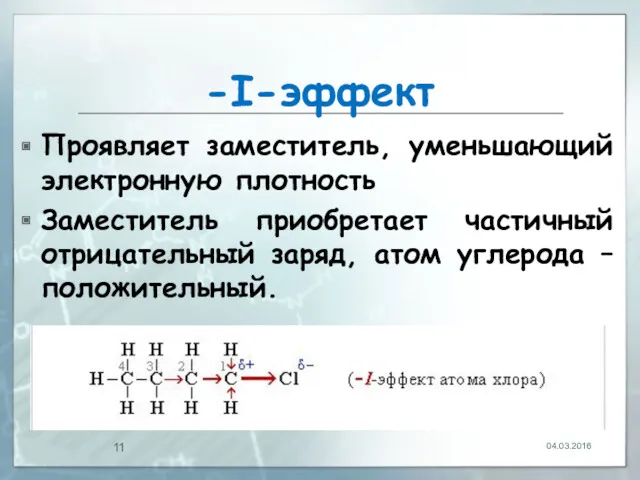
- 11. -I-эффект Проявляет заместитель, уменьшающий электронную плотность Заместитель приобретает частичный отрицательный заряд, атом углерода – положительный. 04.03.2016
- 12. Определение -I-эффекта 04.03.2016
- 13. +I-эффект Проявляет заместитель, увеличива-ющий электронную плотность Заместитель приобретает частичный положительный заряд, атом углерода – отрицательный. 04.03.2016
- 14. Определение +I-эффекта 04.03.2016
- 15. Мезомерный эффект Передача электронного влияния заместителей по сопряжённой π-системе. Благодаря подвижности π-электронов передаётся по цепи без
- 16. Мезомерный эффект Графически изображают изогнутыми стрелками. В зависимости от направления смещения электронной плотности различают отрицательный (-М)
- 17. Правила определения величины и знака М-эффекта 04.03.2016
- 18. Правило 1. Величина М-эффекта растет с увеличением заряда заместителя. Ионы проявляют наиболее сильный М-эффект: 04.03.2016
- 19. Правило 2 -М-эффект заместителей тем сильнее, чем больше электроотрицательность имеющихся в заместителе элементов: 04.03.2016
- 20. Правило 3 -М-эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия (делокализация электронов), например: 04.03.2016
- 21. Правило 3 Группа С=О в этом случае связана с группировками, +М-эффект которых в ряду O-, NH2,
- 22. Правило 3 В хлорацильной группе -С(О)Cl атом хлора проявляет +М-эффект, однако он значительно слабее -I-эффекта мезомерное
- 23. Правило 4 +М-эффект заместителя тем сильнее, чем меньше электроотрицательность гетероатома, входящего в его состав: 04.03.2016
- 24. Правило 4 Исключение составляют галогены: 04.03.2016
- 25. Правило 4 Причина этого явления заключается в том, что эффективность перекрывания 2р-АО sp2-гибридизованного атома углерода с
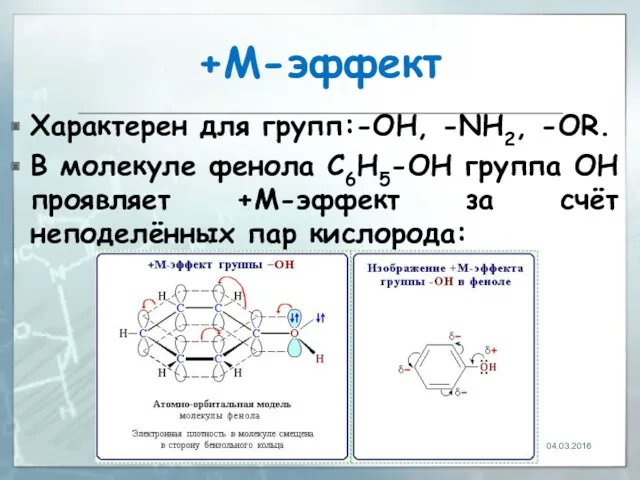
- 26. +М-эффект Характерен для групп:-OH, -NH2, -OR. В молекуле фенола C6H5-OH группа ОН проявляет +М-эффект за счёт
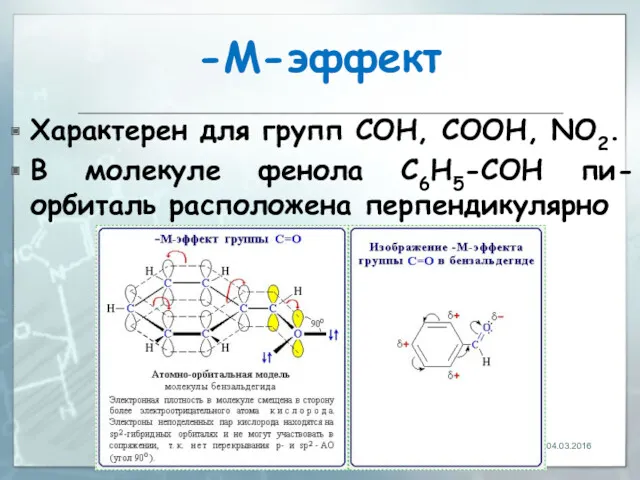
- 27. -М-эффект Характерен для групп СOH, СООН, NО2. В молекуле фенола C6H5-СOH пи-орбиталь расположена перпендикулярно 04.03.2016
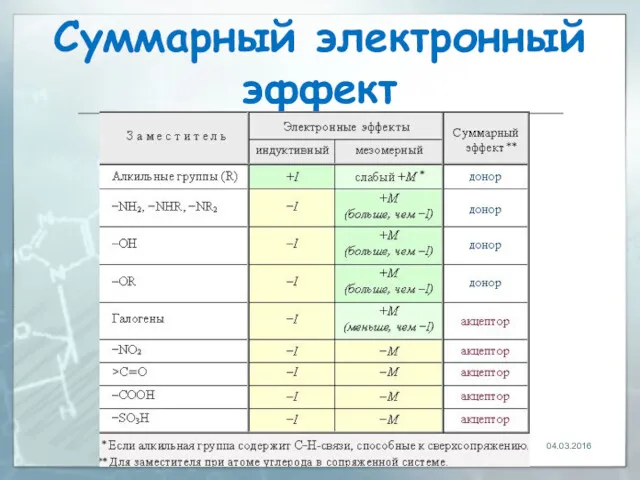
- 28. Суммарный электронный эффект В случае противоположной направленности индуктивного и мезомерного эффектов общее действие заместителя определяется более
- 29. Суммарный электронный эффект в молекуле анилина аминогруппа NH2 одновременно проявляет -I-эффект (за счет большей электроотрицательности атома
- 30. Суммарный электронный эффект аминогруппа является электроно-донорным заместителем, т.к. преобладает более сильный +М-эффект. отрицательный I-эффект относительно слаб:
- 31. Суммарный электронный эффект Аналогичная ситуация (+М > -I) характерна для групп: -NHR, -NR2, -OH, -OR, связанных
- 32. Суммарный электронный эффект В случае галогенов, напротив, преобладает -I-эффект, поскольку, кроме максимально электроотрицательного фтора (очень сильный
- 33. Суммарный электронный эффект 04.03.2016
- 34. Пространственные эффекты (стерические) эффекты определяют доступность реакционных центров в молекуле. Объёмные группы могут блокировать центры в
- 35. Пространственные эффекты Скорость реакции присоединения по С=О-группе снижается в ряду: 04.03.2016
- 36. Эффект сверхсопряжения Группа метил CH3 (в меньшей степени, CH2R и СHR2), связанная с sp2 или sp-атомом,
- 37. Эффект сверхсопряжения с π-молекулярной орбиталью кратной связи (σ, π-сопряжение): 04.03.2016
- 38. Эффект сверхсопряжения с р-атомной орбиталью (σ, р-сопряжение): 04.03.2016
- 39. Эффект сверхсопряжения Графически эффект сверхсопряжения обозначается изогнутой стрелкой, охватывающей С-Н связи и направленной в сторону π-связи
- 40. Эффект сверхсопряжения Направление стрелки показывает смещение σ-электронов связи С-Н в сторону кратной связи или р-АО. метильная
- 41. Эффект сверхсопряжения сверхсопряжение является слабым эффектом, но его роль в стабилизации вторичных и, тем более, третичных
- 42. Эффект сверхсопряжения Именно этим фактором, в частности, объясняется увеличение устойчивости свободных радикалов в ряду: 04.03.2016
- 43. Эффект сверхсопряжения В той же последовательности возрастает устойчивость карбокатионов, которая обусловлена как +I-эффектом алкильных групп, так
- 44. Эффект сверхсопряжения Наибольшая стабильность трет-бутил-катиона +C(CH3)3 объясняется не только действием +I-эффекта, но и делокализацией положительного заряда
- 45. 1.Контрольная работа 04.03.2016
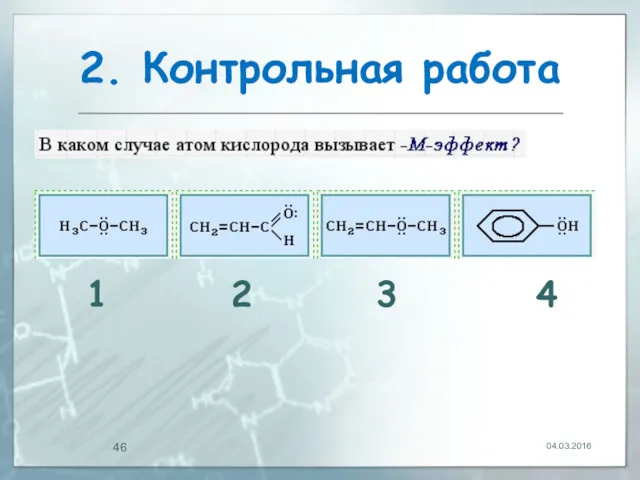
- 46. 2. Контрольная работа 04.03.2016 1 2 3 4
- 47. 3.Контрольная работа 04.03.2016
- 48. 4. Контрольная работа 04.03.2016
- 49. 5. Контрольная работа К какому типу органических соединений относится хлоропрен (вещество для получения синтетического каучука): 04.03.2016
- 50. 6. Контрольная работа Функциональной группой фенолов является . . . 04.03.2016 Ответ 1: группа -NH2 Ответ
- 52. Скачать презентацию












































 Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії Группа ультраосновных пород
Группа ультраосновных пород Аммиак
Аммиак Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Карбонильные соединения. Альдегиды
Карбонильные соединения. Альдегиды Уральские самоцветы
Уральские самоцветы Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Гибридизация. Формы электронных облаков
Гибридизация. Формы электронных облаков Классификация химических реакций
Классификация химических реакций Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Задачи на вывод формулы органических веществ
Задачи на вывод формулы органических веществ Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях кл.химия 24.01
кл.химия 24.01 Химические свойства получение и применение солей
Химические свойства получение и применение солей Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Введение в количественный анализ
Введение в количественный анализ Хімічна кінетика
Хімічна кінетика Различные теории кислот и оснований
Различные теории кислот и оснований Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Галогены. История открытия галогенов
Галогены. История открытия галогенов Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Щелочные породы среднего состава
Щелочные породы среднего состава Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Назначение установки Пенекс
Назначение установки Пенекс