Содержание
- 2. А Л Ь Д Е Г И Д Ы - органические вещества, молекулы которых содержат карбонильную
- 3. Классификация. По характеру углеводородного радикала: предельные, непредельные, ароматические. Например:
- 4. Изомерия альдегидов: изомерия углеродного скелета, начиная с С4 межклассовая изомерия с кетонами, начиная с С3
- 5. Строение. В карбонильной группе связь между атомами углерода и кислорода – двойная. Атом углерода находится в
- 6. Физические свойства. Метаналь (формальдегид) – газ, альдегиды С2-C5 – жидкости, высшие – твердые вещества. Низшие гомологи
- 7. Физические свойства некоторых альдегидов Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие
- 8. Химические свойства. Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов. Реакции присоединения. 1. Гидрирование –
- 9. Химические свойства Реакции окисления 1. аммиачным раствором оксида серебра (реакция «серебряного зеркала»). Это качественная реакция на
- 10. Химические свойства 2. гидроксидом меди (II), в результате образуется осадок кирпично-красного цвета (качественная реакция) t° СН3
- 11. Получение 1. Окисление спиртов
- 12. Получение 2. Гидратация алкинов (реакция Кучерова) О t,НgSO4 ̸̸̸ ̸ НС Ξ СН + Н2О →CН3
- 13. Ацетальдегид Альдегиды. Применение. пластмасса Ацетатное волокно
- 15. Булочки ванильные, корицы аромат, Амаретто, шоколад Альдегидов вкус таят В землянике и кокосе И в жасмине
- 16. Отличительной чертой многих альдегидов является их запах. Высшие альдегиды, особенно непредельные и ароматические, входят в состав
- 17. В плодах ванили содержится ароматический альдегид, который придает им характерный запах. Ванилин применяется в парфюмерии, кондитерской
- 18. Фенилэтаналь Фенилэтаналь по сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха. Фенилэтаналь пахнет гиацинтом. Альдегиды в
- 19. Бензальдегид Бензальдегид – жидкость с запахом горького миндаля. Встречается в косточках и семечках, особенно в абрикосах
- 20. Коричный альдегид Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы . Применяется
- 21. Запах цитрусовых обусловлен данным диеновым альдегидом. Его применяют в качестве отдушки средств бытовой химии, косметических и
- 23. Скачать презентацию
 Строение и свойства материалов
Строение и свойства материалов Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Видатні вітчизняні вчені – творці хімічної науки
Видатні вітчизняні вчені – творці хімічної науки Основные классы неорганических соединений
Основные классы неорганических соединений Жидкие кристаллы
Жидкие кристаллы Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Основные классы неорганических соединений. Химические свойства неорганических веществ
Основные классы неорганических соединений. Химические свойства неорганических веществ Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Органикалық қосылыстардың молекуласындағы атомдардың өзара әсері. Индуктивті эффект,қосарлану эффектісі туралы түсінік
Органикалық қосылыстардың молекуласындағы атомдардың өзара әсері. Индуктивті эффект,қосарлану эффектісі туралы түсінік Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Классы неорганических соединений
Классы неорганических соединений Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Спирты. Классификация спиртов
Спирты. Классификация спиртов Строение и свойства комплексных соединений
Строение и свойства комплексных соединений Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Физические свойства минералов
Физические свойства минералов Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Способы получения и очистки металлов
Способы получения и очистки металлов Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2 Коллигативные свойства растворов
Коллигативные свойства растворов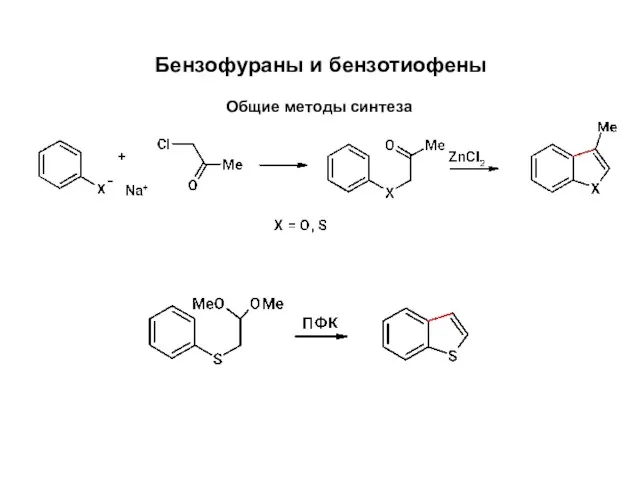 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Виды камней
Виды камней Гідроліз солей
Гідроліз солей Харчові добавки
Харчові добавки Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Растворы электролитов
Растворы электролитов