Содержание
- 2. Основные вопросы темы: Современные представления о строении и свойствах комплексных соединений. Биологическая роль и применение в
- 3. Реагенты в химии Катализаторы Лекарственные препараты Витамины Хлорофилл Гемоглобин И др.
- 4. КС– это такие соединения, в узлах кристаллической решётки которых находятся комплексы или комплексные ионы, способные к
- 5. Примеры реакций комплексообразования HgI2 + 2KI = K2[HgI4] KF + BF3 = K[BF4] Al(OH)3+ NaOH =
- 6. Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 ∙ Н2О Н - связь [Pt(NH3)2 Cl2 ]0 [Ni(CO)4]
- 7. Альфред Вернер Швейцарский химик, 1893г
- 8. Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3 Центральный атом Лиганды Ион внешней сферы Внутреняя сфера Внешняя
- 9. Характеристика центрального атома Комплексообразующая способность элементов f > d > p > s Инертные газы также
- 10. Важнейшие характеристики центрального атома : Степень окисления Координационное число Ионный потенциал
- 11. Степень окисления Положительная K3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4] Отрицательная [N -3H4 ] Cl Нулевая [Cl2(H2O)4]
- 12. Координационное число (КЧ) Это число атомов или групп атомов, непосредственно связанных с центральным атомом
- 13. - от размеров центрального атома и лигандов. Лат. liganda -то, что должно быть связано КЧ зависит:
- 14. Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм
- 15. Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм
- 16. - от степени окисления центрального атома:
- 17. чаще всего кч устойчивого комплекса в два раза больше степени окисления ц.а. КЧ = 2Z Эмпирическое
- 18. Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6] - концентрации исходных компонентов :
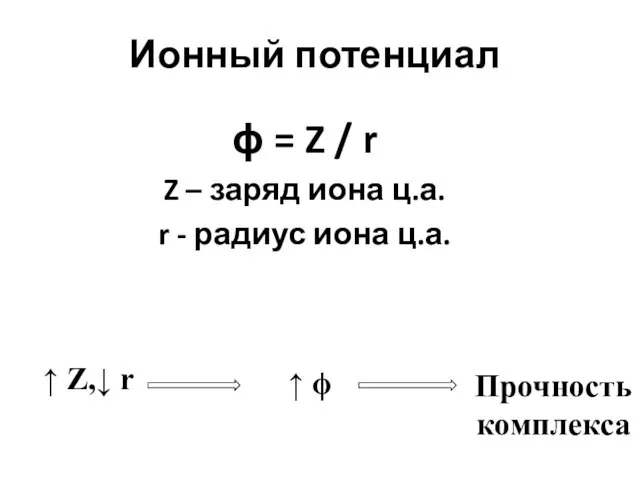
- 19. Ионный потенциал ϕ = Z / r Z – заряд иона ц.а. r - радиус иона
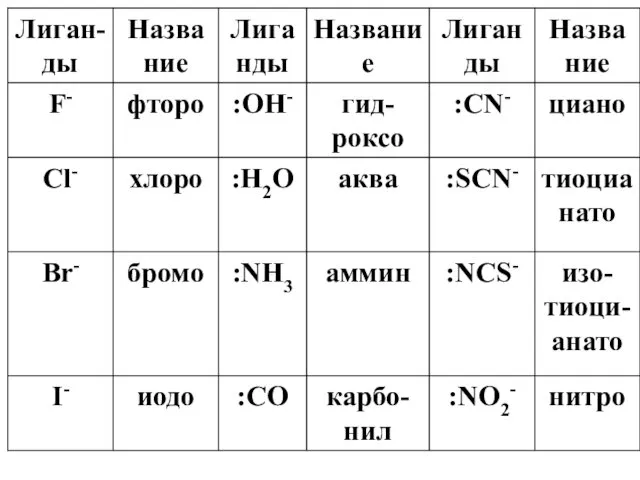
- 20. Характеристика лигандов
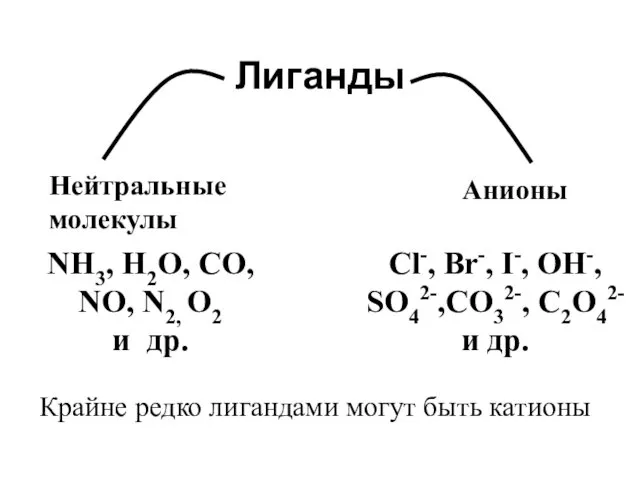
- 21. Лиганды NH3, H2O, CO, NO, N2, O2 и др. Cl-, Br-, I-, OH-, SO42-,CO32-, C2O42- и
- 22. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-) Число донорных атомов в
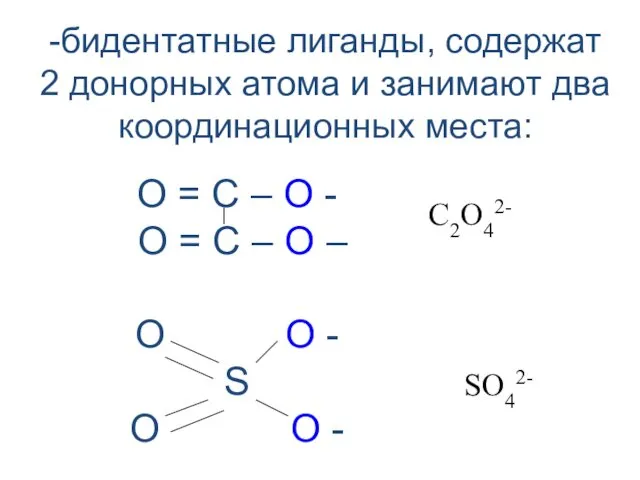
- 23. -бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О
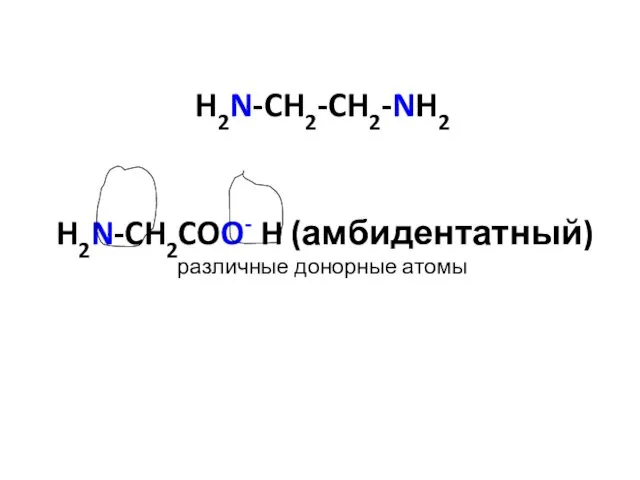
- 24. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
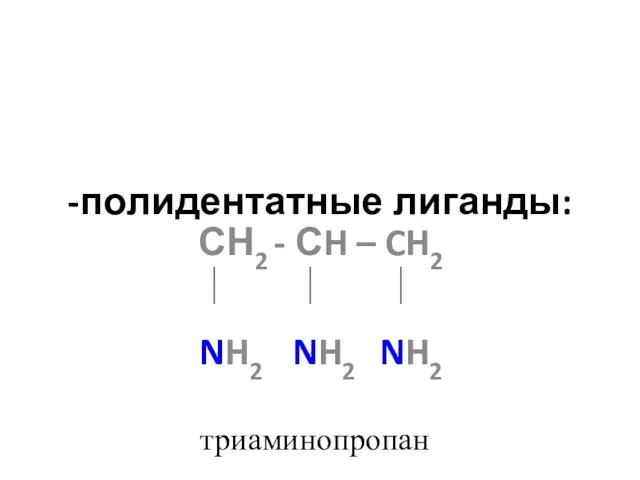
- 25. -полидентатные лиганды: СН2 - СH – CH2 NH2 NH2 NH2 триаминопропан
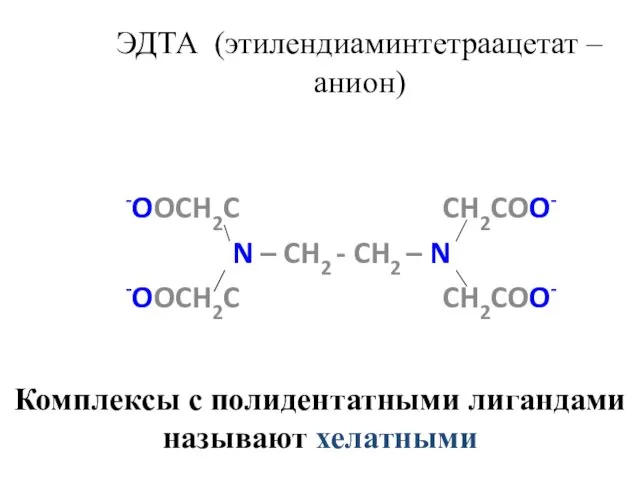
- 26. ЭДТА (этилендиаминтетраацетат –анион) -OOCH2C CH2COO- N – CH2 - CH2 – N -OOCH2C CH2COO- Комплексы с
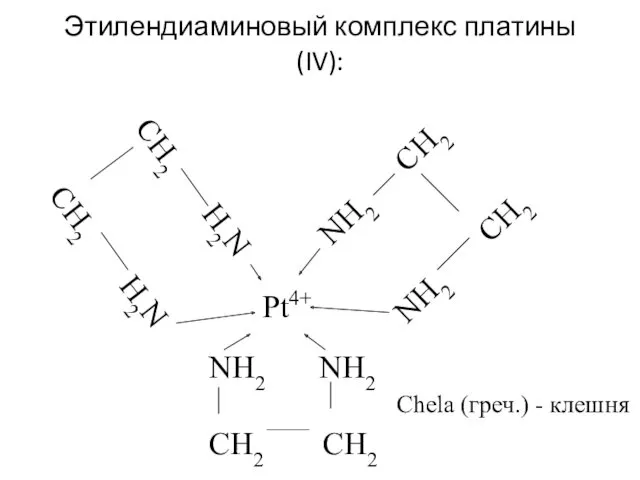
- 27. Этилендиаминовый комплекс платины(IV): Chela (греч.) - клешня
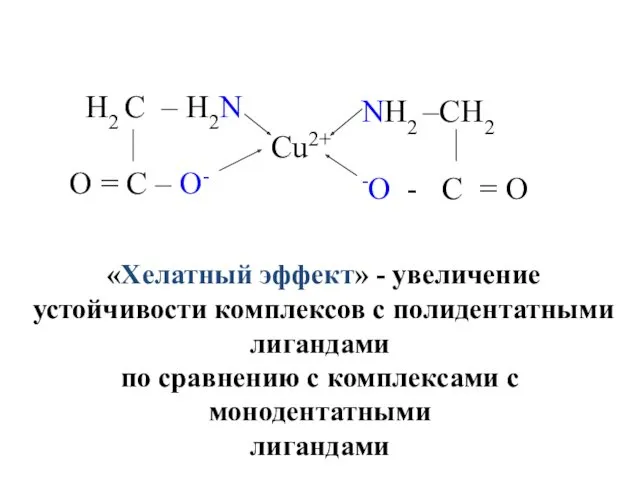
- 28. «Хелатный эффект» - увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
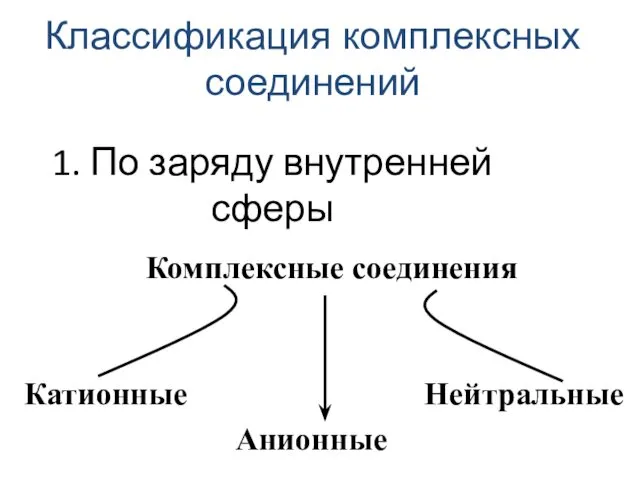
- 29. 1. По заряду внутренней сферы Классификация комплексных соединений
- 30. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-
- 31. 2. По природе лиганда: Гидроксокомплексы ( ОН-) Аквакомплексы (Н2О) Аммиакатные комплексы (NH3) Ацидокомплексы ( CN- -
- 32. Классификация КС по природе лигандов
- 33. 3. По способности ионизировать: Электролиты [Cu(NH3)4]SO4 Неэлектролиты [Pt(NH3)2Cl2] 4. По свойствам электролита: Кислоты Н[AuCl4] Основания [Cu(Н2О)4](ОН)2
- 34. Номенклатура комплексных соединений
- 36. [Cu(NH3)4]SO4 [Cr (NH3)3(H2O)2 Cl]Br2 Бромид хлородиакватриамминхрома (III) Na3[Co(NO2)6] ГГексанитрокобальтат (III) натрия [Pt(NH3)2Cl2] Сульфат тетраамминмеди (II) Гексанитрокобальтат
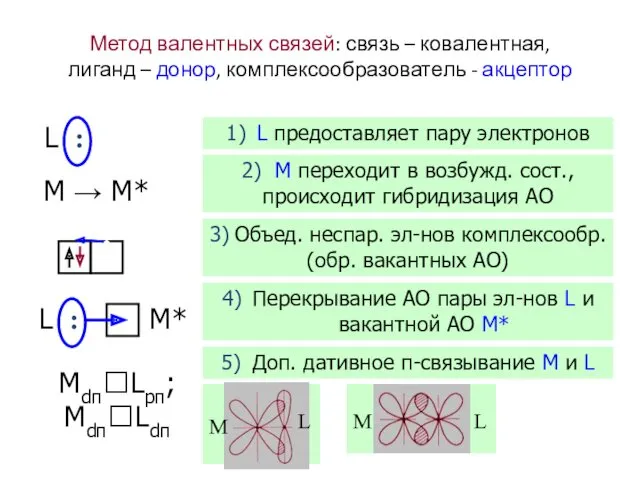
- 37. Природа химической связи в комплексных соединениях
- 38. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь - акцептор L : M →
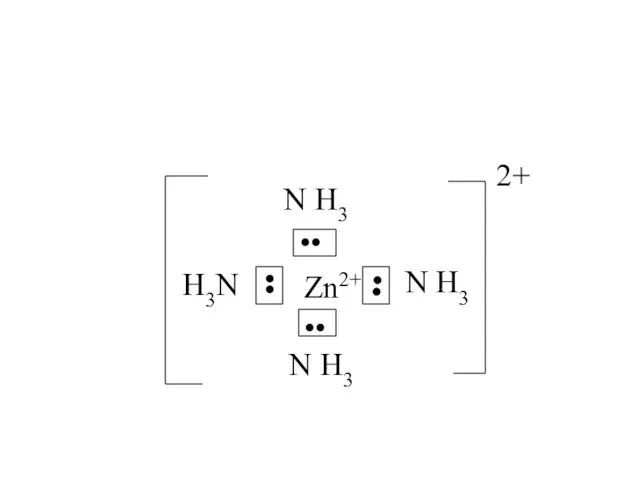
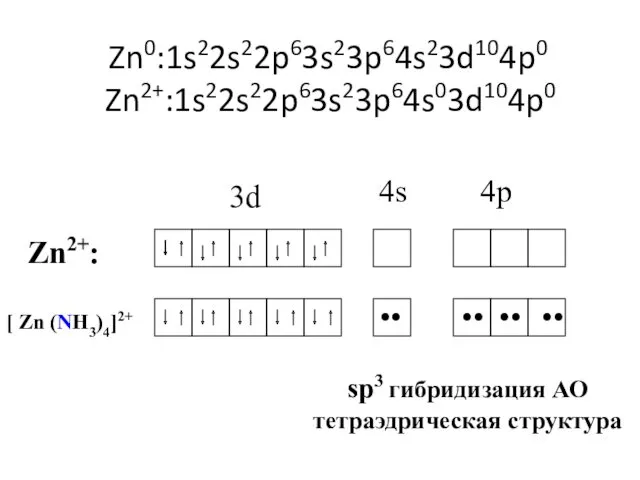
- 39. Zn2+ + 4 NH3 → [Zn(NH3)4]2+
- 40. Zn2+ •• •• •• •• N H3 N H3 N H3 H3N 2+
- 41. Zn0:1s22s22p63s23p64s23d104p0 Zn2+:1s22s22p63s23p64s03d104p0 3d 4s 4p Zn2+: •• •• •• •• [ Zn (NH3)4]2+ sp3 гибридизация АО
- 42. 3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+ •• •• d2sp3 гибридизация АО октаэдрическая
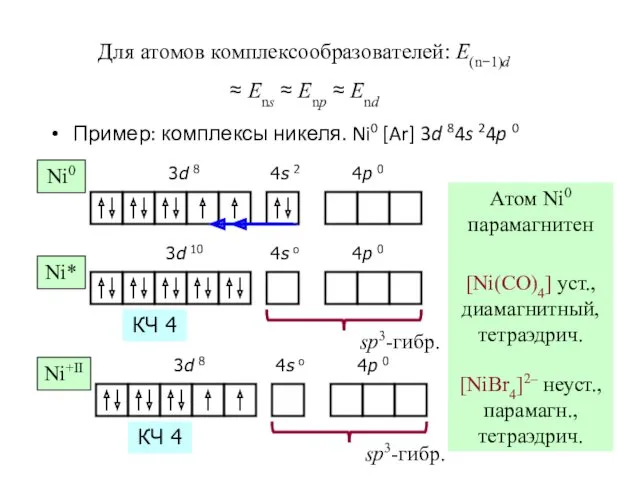
- 43. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar] 3d
- 44. Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн., квадратная пирамида КЧ 5 [Ni(H2O)6]2+, [Ni(NO2)6]4–
- 45. Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6
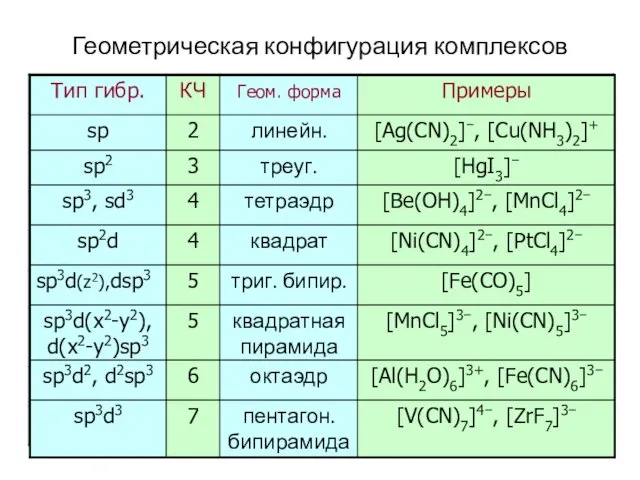
- 46. Геометрическая конфигурация комплексов
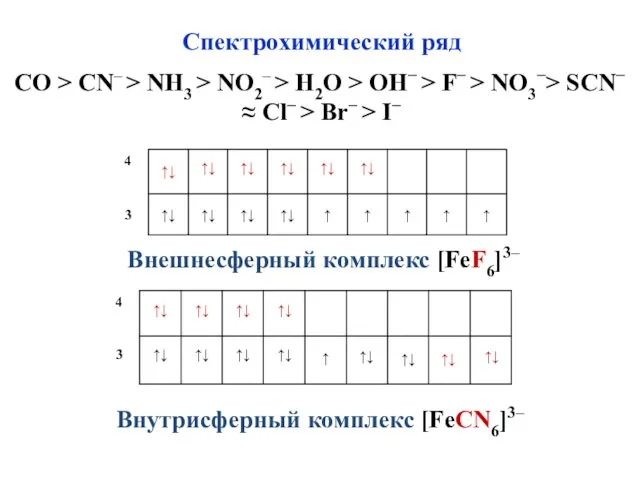
- 47. Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH− > F− >
- 48. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ Лиганды – точечные заряды (кристаллическое поле). Связь между лиогандами и ценртральным атомом чисто
- 49. В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия падает) в случае АО d(xy),
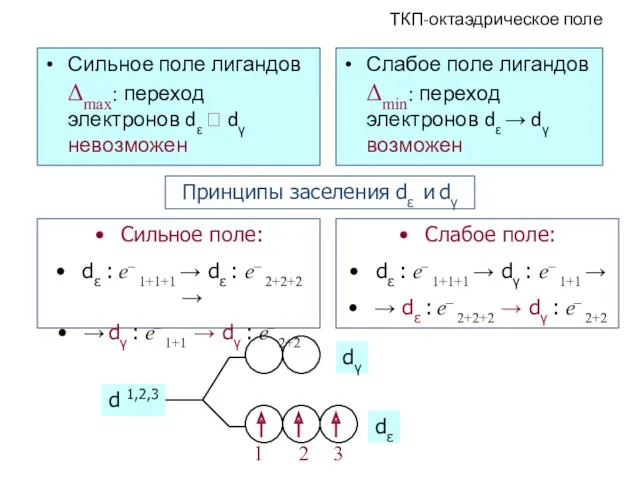
- 50. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен Слабое поле лигандов Δmin:
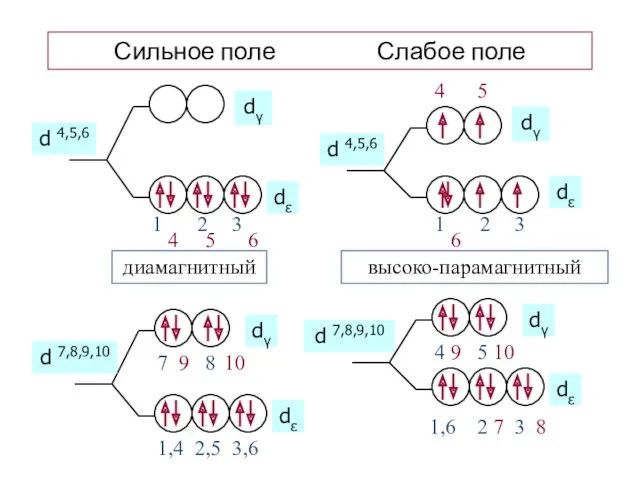
- 51. Сильное поле Слабое поле d 4,5,6 d 4,5,6 диамагнитный высоко-парамагнитный d 7,8,9,10 d 7,8,9,10
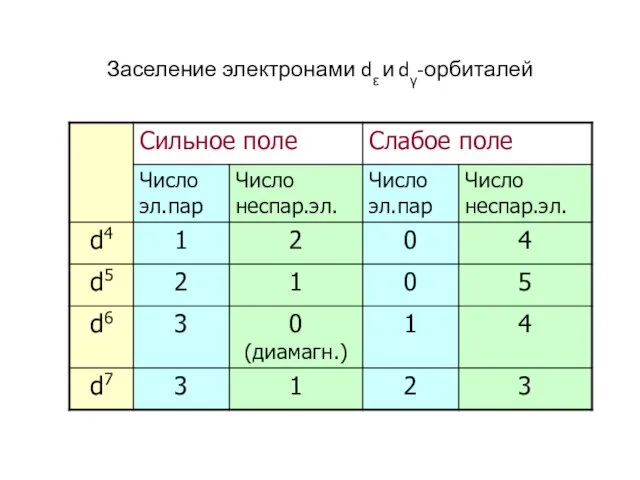
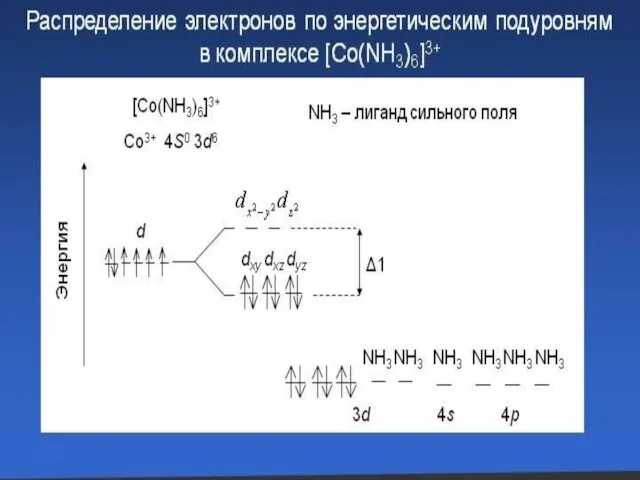
- 52. Заселение электронами dε и dγ-орбиталей
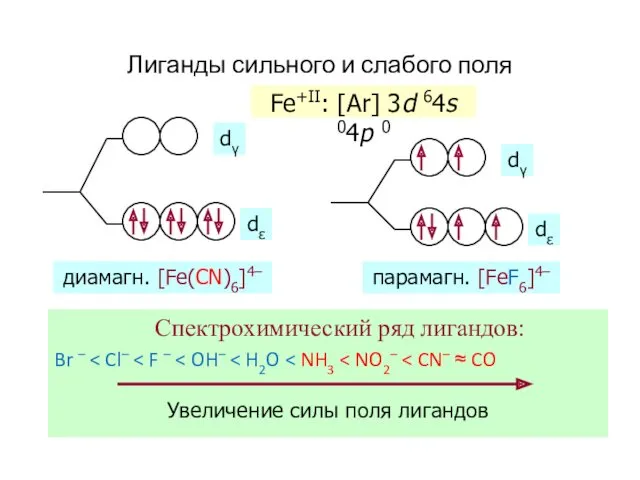
- 53. Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – Fe+II: [Ar] 3d 64s 04p 0
- 54. [Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля лигандов Влияние поля лигандов на окраску
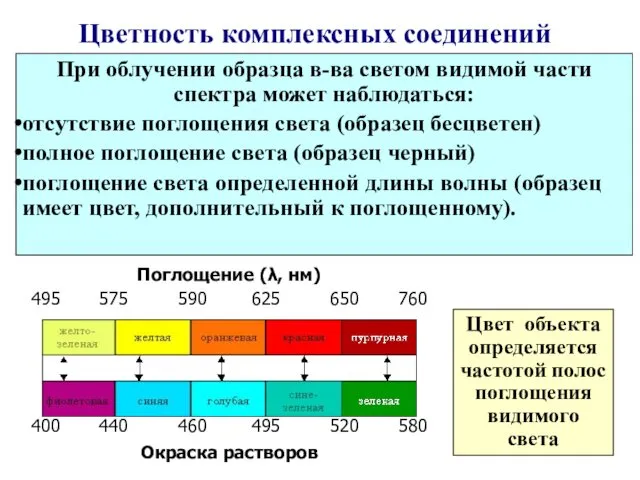
- 55. Цветность комплексных соединений При облучении образца в-ва светом видимой части спектра может наблюдаться: отсутствие поглощения света
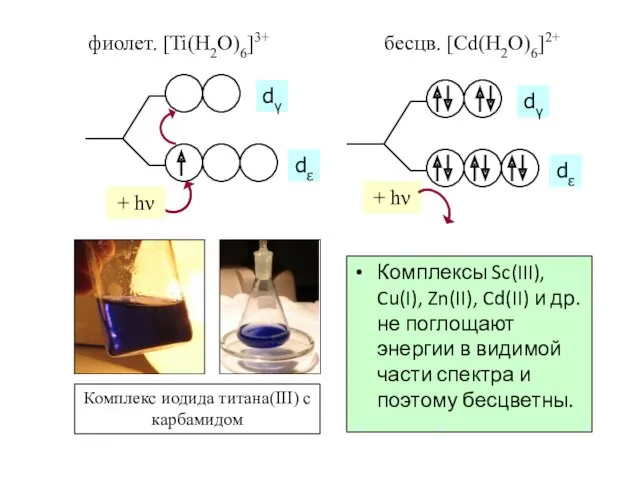
- 56. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра
- 59. Изомерия комплексных соединений Изомерия – явление существования соединений, одинаковых по составу и мол. массе, но различающихся
- 60. Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р) [Co(NH3)5ONO]2+ (розов.р-р) —NCS– и —SCN– тиоцианато-N
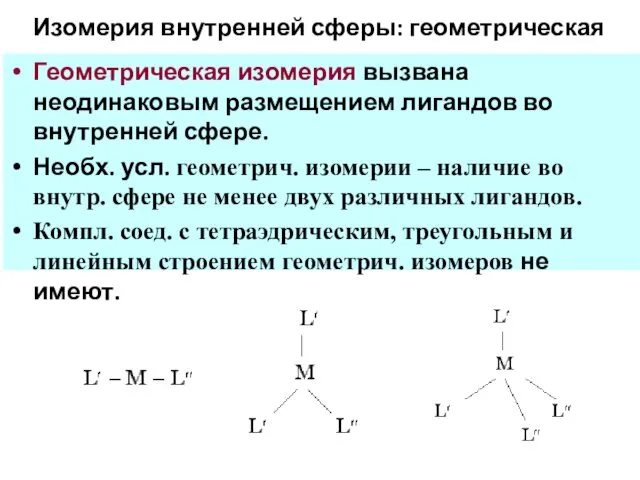
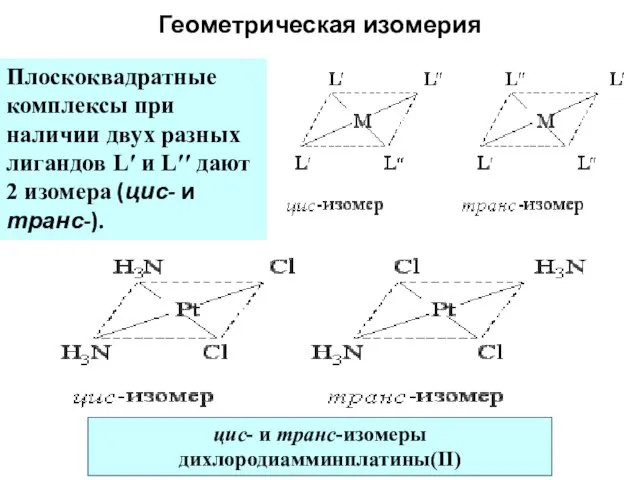
- 61. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере. Необх. усл. геометрич.
- 62. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′ дают 2 изомера (цис-
- 63. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
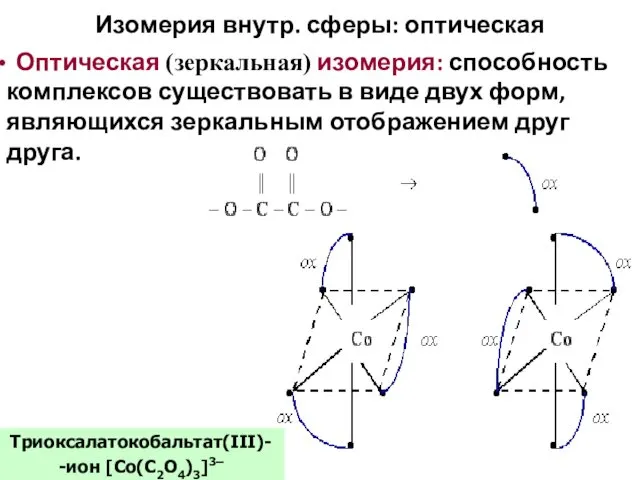
- 64. Изомерия внутр. сферы: оптическая Оптическая (зеркальная) изомерия: способность комплексов существовать в виде двух форм, являющихся зеркальным
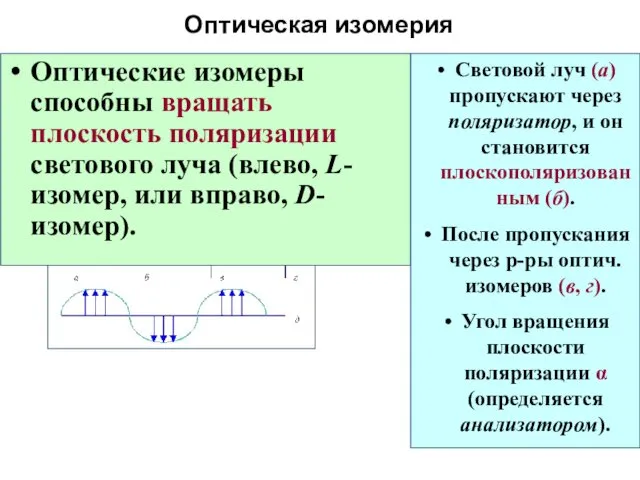
- 65. Оптическая изомерия Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер, или вправо, D-изомер). Световой
- 66. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O [Co(H2O)(en)2Cl]Cl2 [Co(NH3)5I]SO4 [Co(NH3)5SO4]I 1 Cl–;
- 67. Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH >> 7 pH ≈
- 68. Диссоциация комплексных соединений
- 69. K4 [Fe(CN)6]
- 70. K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
- 71. [Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости (Кн): Kн = 1ּ10-31 (очень прочный
- 72. [Ni(NH3)6]2+ Кн = 2·10-9 (непрочный комплекс) Куст.=1/ Кн
- 73. Кн и Ку (β)относятся только к комплексному иону! Не забывайте !
- 74. Правило циклов Чугаева Наибольшей устойчивостью обладают пяти- и шестичленные металлоциклы. Соединения с трех-, четырехчленными циклами и
- 75. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)
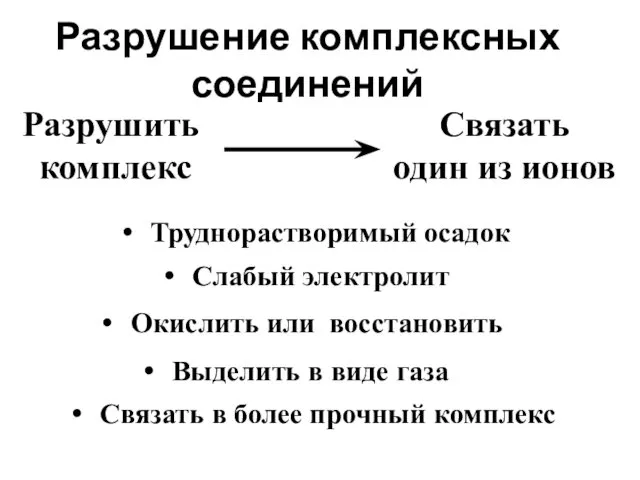
- 76. Разрушение комплексных соединений Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в
- 77. [Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8
- 78. [Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ Кs(AgI) = 1,5·10 -16 [Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3 Кн
- 79. [Ag (NH3)2]+↔ Ag+ + 2 NH3
- 80. Использование реакций комплексообразования в фармацевтическом анализе: Для обнаружения ионов. Например, ионы кобальта (II) можно отрыть реакцией
- 81. Для маскировки мешающих ионов. Например, при обнаружении ионов Ni2+ в присутствии Fе3+, последний связывают в устойчивый
- 82. Для изменения окислительно-восстановительных свойств ионов. Например, молибден (VI) в виде МоО3⋅Н2О не окисляет бензидин, а комплексный
- 83. Биологическая роль комплексных соединений
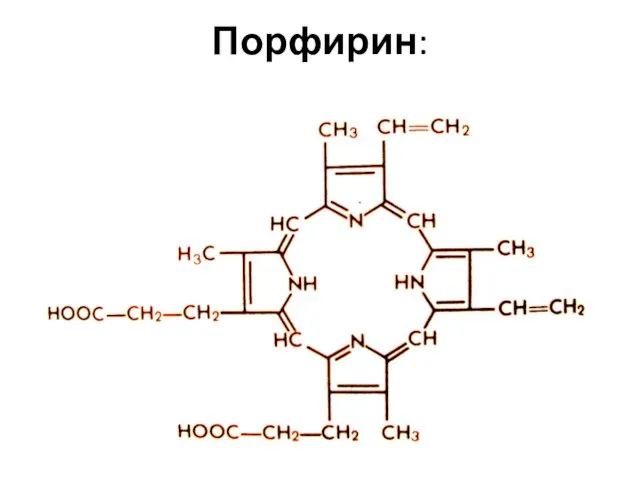
- 84. Порфирин:
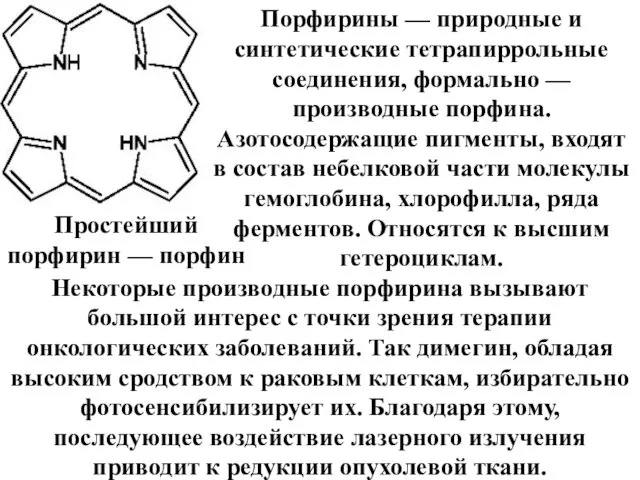
- 85. Простейший порфирин — порфин Порфирины — природные и синтетические тетрапиррольные соединения, формально — производные порфина. Азотосодержащие
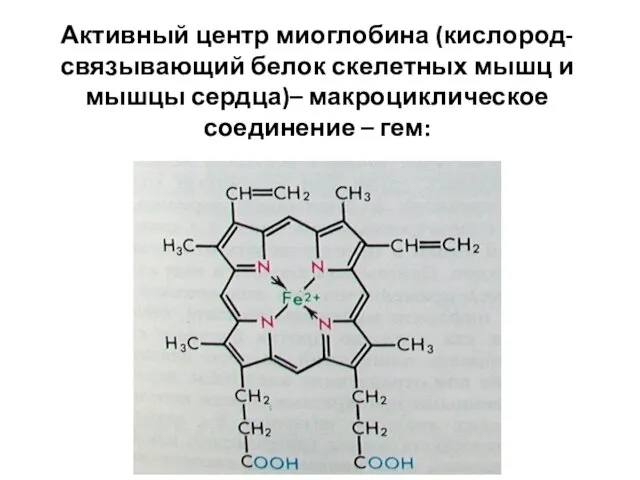
- 86. Активный центр миоглобина (кислород-связывающий белок скелетных мышц и мышцы сердца)– макроциклическое соединение – гем:
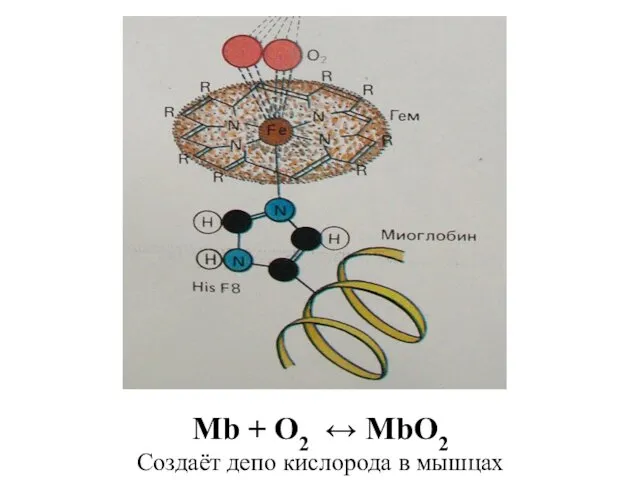
- 87. Mb + O2 ↔ MbO2 Создаёт депо кислорода в мышцах
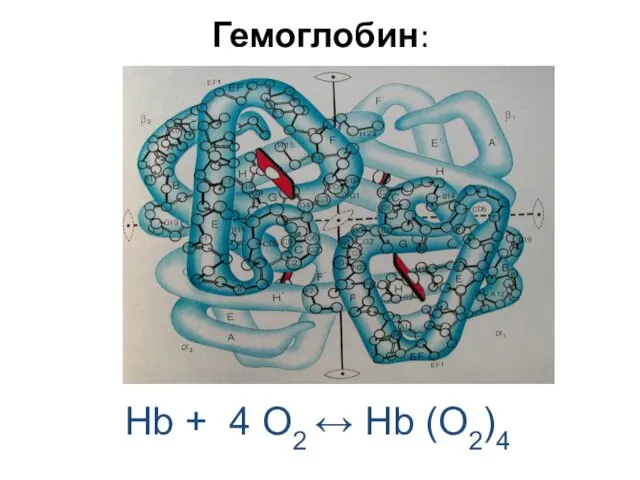
- 88. Гемоглобин: Hb + 4 O2 ↔ Hb (O2)4
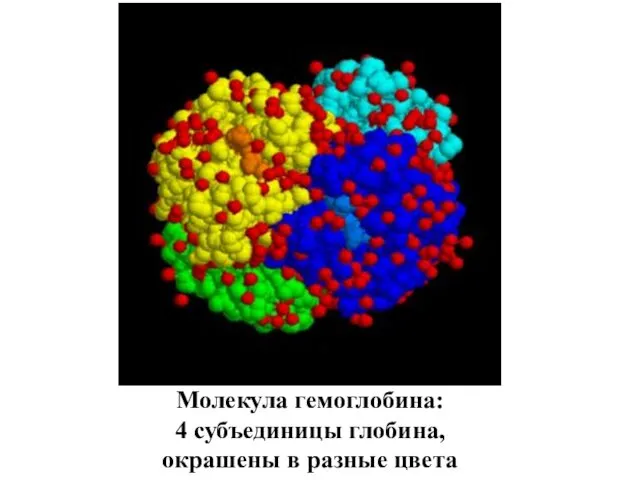
- 89. Молекула гемоглобина: 4 субъединицы глобина, окрашены в разные цвета
- 90. Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок. Главная
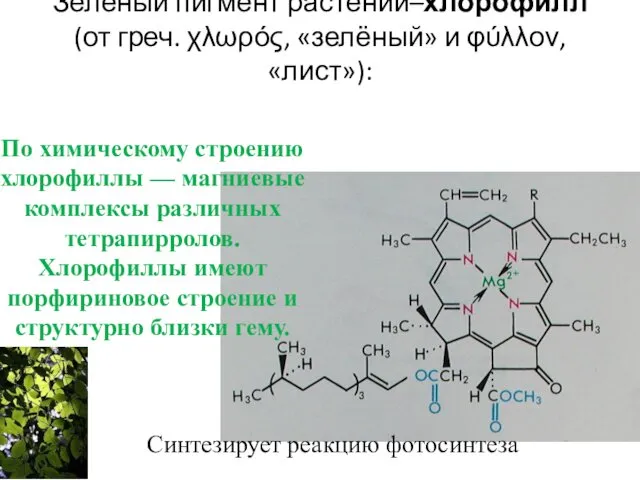
- 91. Зеленый пигмент растений–хлорофилл (от греч. χλωρός, «зелёный» и φύλλον, «лист»): Синтезирует реакцию фотосинтеза По химическому строению
- 92. Применение комплексных соединений в медицине
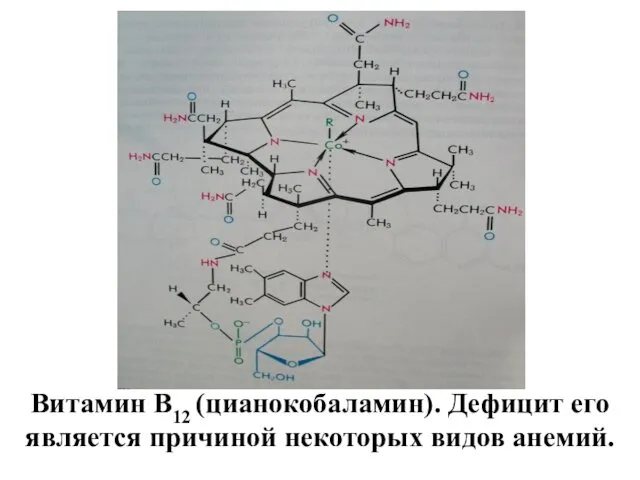
- 93. Витамин В12 (цианокобаламин). Дефицит его является причиной некоторых видов анемий.
- 94. Унитиол - антидот при отравлениях соединениями мышьяка, ртути и солями тяжелых металлов) Меркаптидная связь
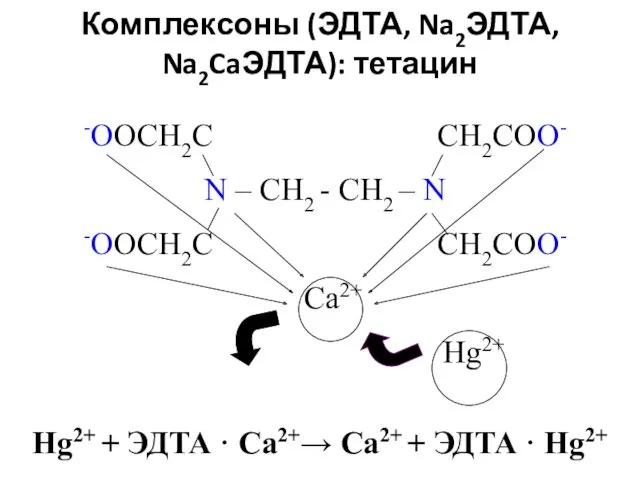
- 95. Комплексоны (ЭДТА, Na2ЭДТА, Na2CaЭДТА): тетацин -OOCH2C CH2COO- N – CH2 - CH2 – N -OOCH2C CH2COO-
- 96. Противоопухолевый препарат: цис-изомер дихлородиамминплатины ЦИСПЛАТИН — цитотоксический препарат алкилирующего действия [Pt(NH3)2Cl2]
- 98. Скачать презентацию



![Примеры реакций комплексообразования HgI2 + 2KI = K2[HgI4] KF +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-4.jpg)
![Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 ∙ Н2О Н - связь [Pt(NH3)2 Cl2 ]0 [Ni(CO)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-5.jpg)

![Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3 Центральный атом Лиганды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-7.jpg)


![Степень окисления Положительная K3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4] Отрицательная [N -3H4 ] Cl Нулевая [Cl2(H2O)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-10.jpg)


![Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-13.jpg)
![Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-14.jpg)


![Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6] - концентрации исходных компонентов :](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-17.jpg)


![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-29.jpg)


![3. По способности ионизировать: Электролиты [Cu(NH3)4]SO4 Неэлектролиты [Pt(NH3)2Cl2] 4. По](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-32.jpg)

![[Cu(NH3)4]SO4 [Cr (NH3)3(H2O)2 Cl]Br2 Бромид хлородиакватриамминхрома (III) Na3[Co(NO2)6] ГГексанитрокобальтат (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-35.jpg)

![Zn2+ + 4 NH3 → [Zn(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-38.jpg)
![3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-41.jpg)
![Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ 4 [Ni(CN)5]3– уст., диамагн.,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-43.jpg)
![Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ 6 Fe+II [Fe(CN)6]4– уст., диамагн., октаэдр КЧ 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-44.jpg)

![В случае [ML6]ν±,0 : октаэдрическое поле лигандов Поле слабо влияет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-48.jpg)
![[Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-53.jpg)


![Изомерия лигандов Связевая —NO2– и —ONO– нитро- нитрито- [Co(NH3)5NO2]2+ (желто-коричн.р-р)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-59.jpg)
![Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-62.jpg)
![Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-65.jpg)
![Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-66.jpg)

![K4 [Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-68.jpg)
![K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-69.jpg)
![[Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-70.jpg)
![[Ni(NH3)6]2+ Кн = 2·10-9 (непрочный комплекс) Куст.=1/ Кн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-71.jpg)


 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-74.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-76.jpg)
![[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ Кs(AgI) = 1,5·10 -16](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-77.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-78.jpg)







![Противоопухолевый препарат: цис-изомер дихлородиамминплатины ЦИСПЛАТИН — цитотоксический препарат алкилирующего действия [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115707/slide-95.jpg)
 Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Теория электролитической диссоциации
Теория электролитической диссоциации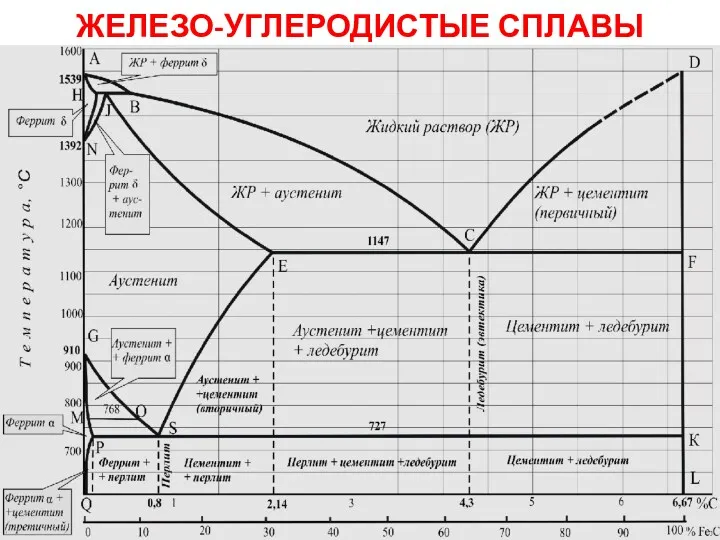 Железо-углеродистые сплавы
Железо-углеродистые сплавы Основные понятия органической химии
Основные понятия органической химии Аминокислоты. Понятие аминокислот
Аминокислоты. Понятие аминокислот Ammonia and amines
Ammonia and amines Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Кальций. Химиялық қасиеті
Кальций. Химиялық қасиеті Соли, их классификация и свойства
Соли, их классификация и свойства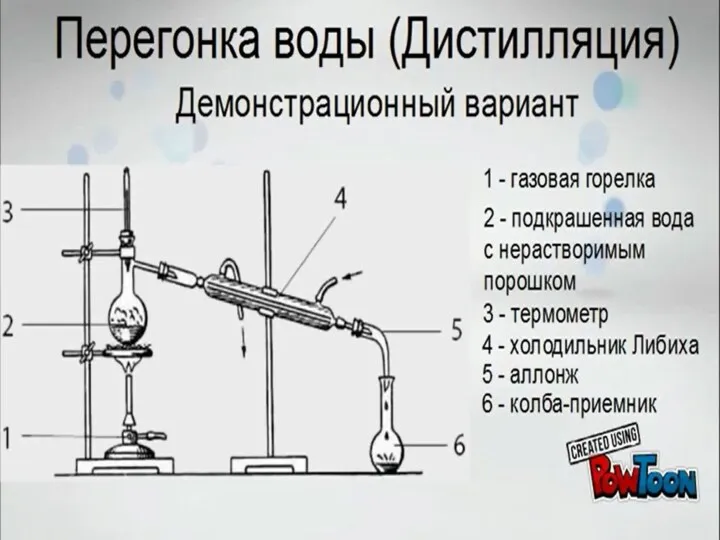 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Металловедение. Классификация металлов
Металловедение. Классификация металлов Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Состав воздуха. Тема 1
Состав воздуха. Тема 1 Лекарства дома
Лекарства дома Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Антибиотики как ЛС
Антибиотики как ЛС Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Основные понятия химии
Основные понятия химии Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Полисахариды. Крахмал
Полисахариды. Крахмал Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы
Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы Соли. Определение солей
Соли. Определение солей Хімічні властивості алканів
Хімічні властивості алканів Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические