Содержание
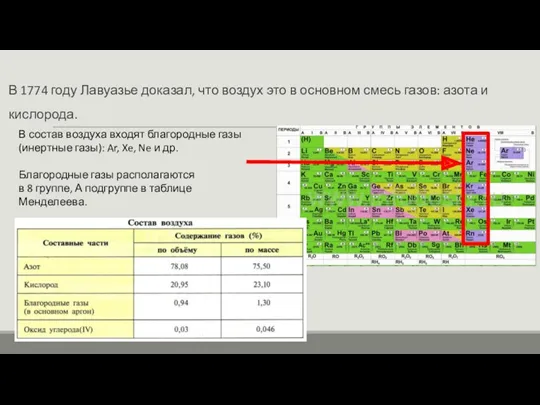
- 2. В 1774 году Лавуазье доказал, что воздух это в основном смесь газов: азота и кислорода. В
- 3. Гелий используется для заполнения воздушных шаров и дирижаблей. Аргон для электросварки легкоокисляющихся металлов. Неон, аргон, криптон,
- 4. Горение веществ на воздухе Горение это реакция с кислородом. В результате такой реакции образуется оксид. Горение
- 5. Горение сложных веществ Любые сложные вещества состоящие из C (углерод) и H (водород) сгорают до CO2
- 6. Условия Возникновения горения: Доступ кислорода Нагревание горючего до температуры воспламенения Прекращение горения: Прекратить доступ кислорода Охладить
- 7. Д/з. с.91 упр.5 (а,б,в,г,д) ДАЛЬШЕ ТЕМА 2. ПО НЕЙ ТОЖЕ КОНСПЕКТ.
- 8. Водород. ТЕМА 2.
- 9. Характеристика Атом – H Аr (H)=16 Молекула водорода всегда пишется H2 Валентность водорода всегда - I.
- 10. Характеристика Бесцветный газ Самый легкий газ Не имеет запах Почти не растворяется ни в каких растворителях
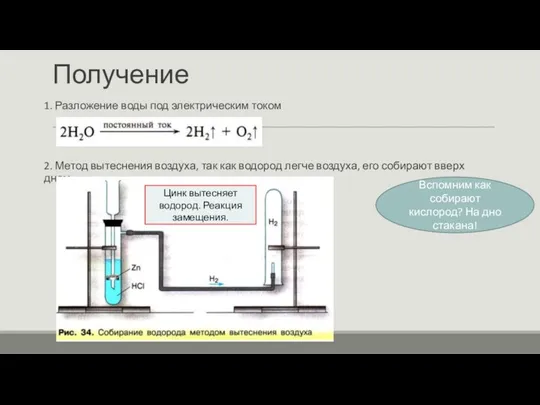
- 11. Получение 1. Разложение воды под электрическим током 2. Метод вытеснения воздуха, так как водород легче воздуха,
- 12. Получение 3. Метод вытеснения воды. Т.к. водород плохо растворяется в воде, он собирается сверху пробирки.
- 13. Химические свойства 1. Взаимодействует с кислородом. Смесь называется гремучий газ 2Н2 + О2 = 2Н2О 2.
- 14. Применение
- 16. Скачать презентацию










 Алотропні форми Карбону
Алотропні форми Карбону Железо и его соединения
Железо и его соединения Включение региональных особенностей Камчатского края в программы учебного предмета химия
Включение региональных особенностей Камчатского края в программы учебного предмета химия Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Углерод и его свойства
Углерод и его свойства Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Механическая смесь и растворы
Механическая смесь и растворы Химическая связь
Химическая связь Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Азотная кислота
Азотная кислота Растворение. Растворы.
Растворение. Растворы. Экспериментальным исследованием установить тип данной химической реакции
Экспериментальным исследованием установить тип данной химической реакции Сложные эфиры
Сложные эфиры Строение атома (лекция 3)
Строение атома (лекция 3) Химия p-элементов. VI и VII группы главные подгруппы
Химия p-элементов. VI и VII группы главные подгруппы Азот – простое вещество. Неметаллы
Азот – простое вещество. Неметаллы Синтетические волокна
Синтетические волокна Способы разделения смесей
Способы разделения смесей Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Реакции ионного обмена
Реакции ионного обмена Ионная химическая связь
Ионная химическая связь Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Титриметрический метод анализа
Титриметрический метод анализа Инертные газы
Инертные газы