Содержание
- 2. Значение растворов Для зарождения жизни (океан) Для поддержания жизни (кровь, др.) Для питания растений и животных
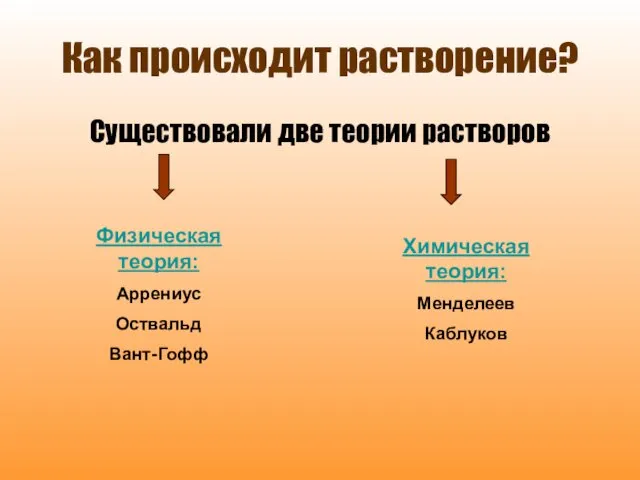
- 3. Как происходит растворение? Существовали две теории растворов Физическая теория: Аррениус Оствальд Вант-Гофф Химическая теория: Менделеев Каблуков
- 4. Физическая теория Растворение – это проникновение частиц одного вещества между частицами другого (растворителя); Это основано на
- 5. Химическая теория При растворении в воде серной кислоты выделяется тепло; Растворение – это химическое явление; Растворенное
- 6. Проанализируем теории Правы ли сторонники физической теории? (правы, диффузия идет); Правы ли сторонники химической теории? (правы,
- 7. Закрепление знаний Какие два процесса происходят при растворении вещества? Как доказать, что растворение – химический процесс?
- 8. Доказательства протекания химических процессов Тепловые явления при растворении: Экзотермические (серная кислота + вода) (Щелочь + вода)
- 9. Уточним понятия Гидраты – непрочные соединения вещества с водой, существующие в растворах; Кристаллогидраты – твердые кристаллические
- 10. Растворимость Это масса вещества, способная раствориться в 100 г растворителя (воды) при стандартных условиях. Растворимость зависит
- 11. Зависимость растворимости от температуры У твердых веществ при повышении температуры растворимость увеличивается (быстрее движутся молекулы, ускоряется
- 12. По растворимости выделяют Хорошо растворимые вещества (в 100г воды растворяется > 1г вещества) Малорастворимые (в 100г
- 13. Работа с графиками Рассмотрите рисунок 123, стр. 189 Вверх или вниз идут графики? Что обозначено по
- 14. Виды растворов Ненасыщенные растворы (вещество еще может растворяться при данной температуре) Насыщенные (вещество уже не может
- 15. Виды растворов Разбавленные (содержат мало растворенного вещества и много растворителя) Концентрированные (содержат много растворенного вещества и
- 17. Скачать презентацию













 Синтетические волокна
Синтетические волокна Хлор. Состав. Строение
Хлор. Состав. Строение Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Нефть. Химический состав нефти
Нефть. Химический состав нефти Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) МЫШЬЯК
МЫШЬЯК Силикат өнеркəсібі
Силикат өнеркəсібі Кислород как элемент
Кислород как элемент Химия и война. Альманах
Химия и война. Альманах Полівінілхлорид
Полівінілхлорид Минерал родонит. Месторождения
Минерал родонит. Месторождения Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Исследование снежного покрова на территории пришкольного участка
Исследование снежного покрова на территории пришкольного участка Азотистый обмен. Взаимосвязь обменов
Азотистый обмен. Взаимосвязь обменов Electron Structure
Electron Structure Химические свойства алкенов
Химические свойства алкенов Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Металлы и сплавы. Общие сведения о металлах и сплавах
Металлы и сплавы. Общие сведения о металлах и сплавах Установка производства серы по методу Клауса
Установка производства серы по методу Клауса Химические формулы
Химические формулы Технологическая установка Л 24-6
Технологическая установка Л 24-6 Бор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Бор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Целлюлоза
Целлюлоза Бытовая химия
Бытовая химия Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні