Содержание
- 2. История открытия хлора В 1774 году шведский химик Карл Вильгельм Шееле (1742 – 1786) провел опыт,
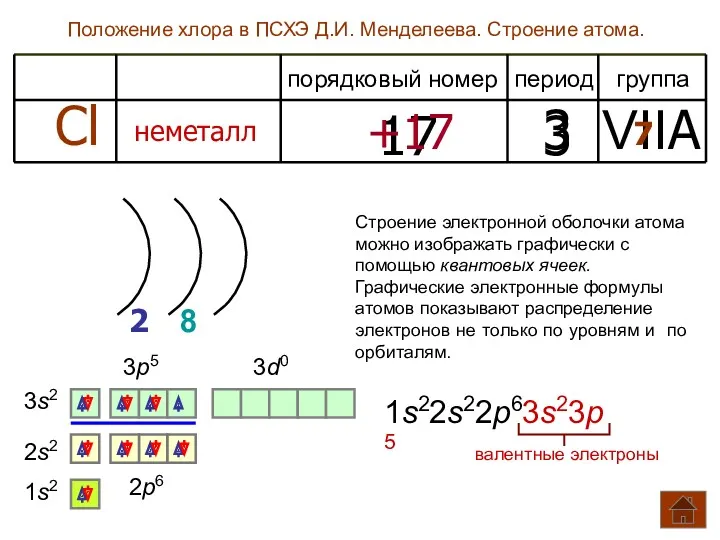
- 3. Положение хлора в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Cl неметалл 17 3
- 4. Нахождение в природе По распространенности в природе хлор занимает 11-е место. Хлор образует следующие важнейшие минералы:
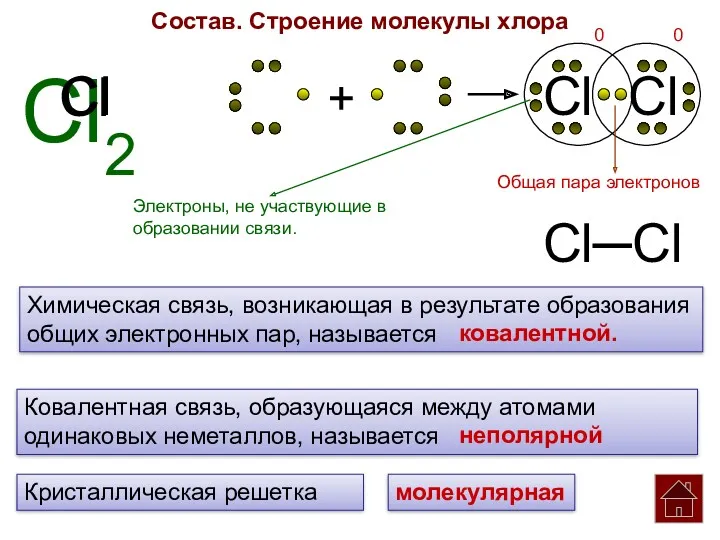
- 5. Cl2 Cl Cl + Cl Cl Состав. Строение молекулы хлора Химическая связь, возникающая в результате образования
- 6. Получение хлора В лаборатории: 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O В промышленности хлор получают электролизом раствора или расплава хлорида натрия. 2NaCl
- 7. Химические свойства хлора Взаимодействие с простыми веществами: а) металлами б) неметаллами 2. Взаимодействие со сложными веществами
- 8. Взаимодействие с простыми веществами (металлами): а)Наиболее энергично хлор реагирует с металлами, причем с некоторыми из них
- 9. Взаимодействие хлора с фосфором Составьте уравнение реакции. Рассмотрите с т.зр. ОВР. Взаимодействие с простыми веществами (неметаллами)
- 10. Взаимодействие хлора с водородом Составьте уравнение реакции взаимодействия хлора с водородом. Рассмотрите с т. зр. ОВР
- 11. Взаимодействие со сложными веществами F2 Cl2 Br2 I 2 уменьшение окислительных свойств увеличение восстановительных свойств Хлор
- 12. Хлор вступает в реакции с органическими веществами
- 13. Взаимодействие хлора с органическими растворителями Растворение хлора в воде сопровождается и химическим взаимодействием. Cl2 + H2O
- 14. Кислородные соединения хлора Хлор непосредственно с кислородом не взаимодействует, однако этот галоген образует достаточно много кислородных
- 15. Применение хлора 1. Хлорирование воды 3. Средства защиты растений 6. Растворители 7. Красители 8. Отбеливание ткани
- 16. Cl2 1 2 3 4 5 6 7 8
- 18. Скачать презентацию













 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций