Содержание
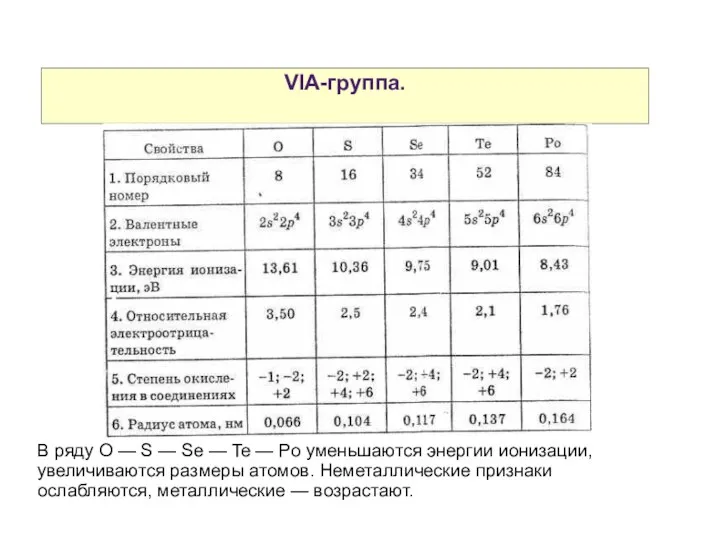
- 2. VIA-группа. В ряду O — S — Se — Te — Po уменьшаются энергии ионизации, увеличиваются
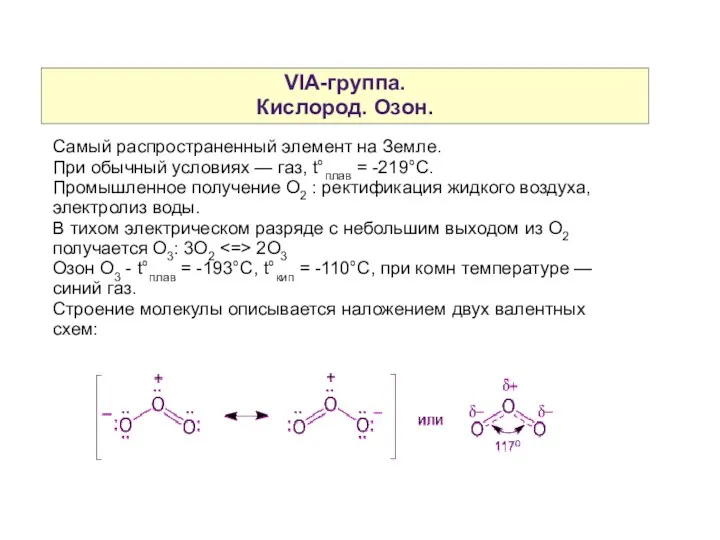
- 3. VIA-группа. Кислород. Озон. Самый распространенный элемент на Земле. При обычный условиях — газ, t°плав = -219°С.
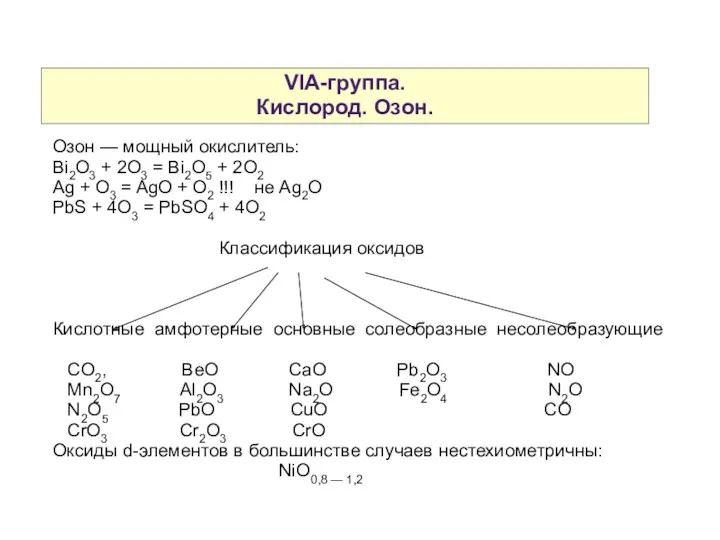
- 4. VIA-группа. Кислород. Озон. Озон — мощный окислитель: Bi2O3 + 2O3 = Bi2O5 + 2O2 Ag +
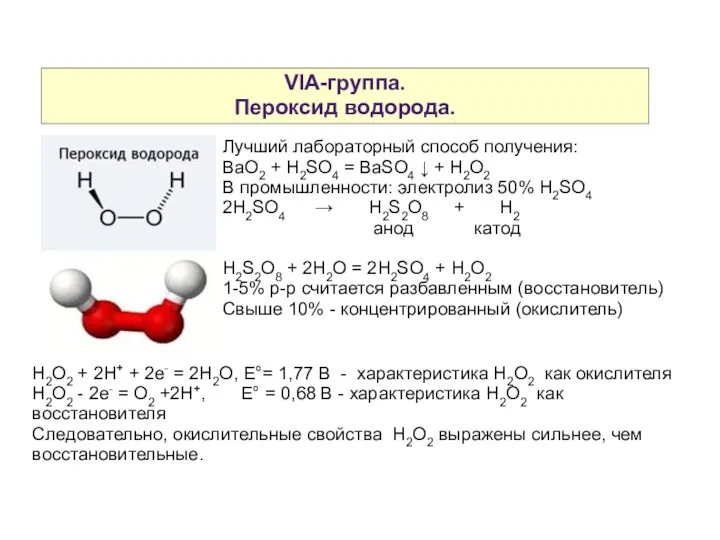
- 5. VIA-группа. Пероксид водорода. Лучший лабораторный способ получения: BaO2 + H2SO4 = BaSO4 ↓ + H2O2 В
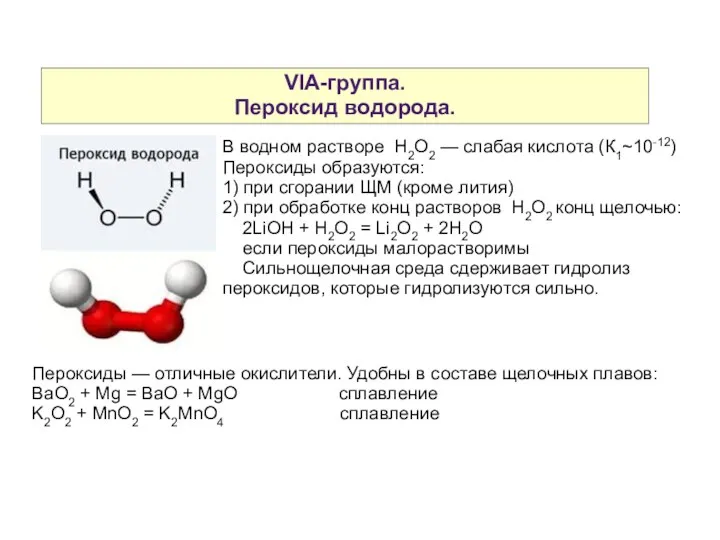
- 6. VIA-группа. Пероксид водорода. В водном растворе H2O2 — слабая кислота (К1~10-12) Пероксиды образуются: 1) при сгорании
- 7. VIA-группа. Сера. Содержание в природе. Самородная сера Сульфиды: пирит FeS2 цинковая обманка ZnS (сфалерит) Сульфаты: Глауберова
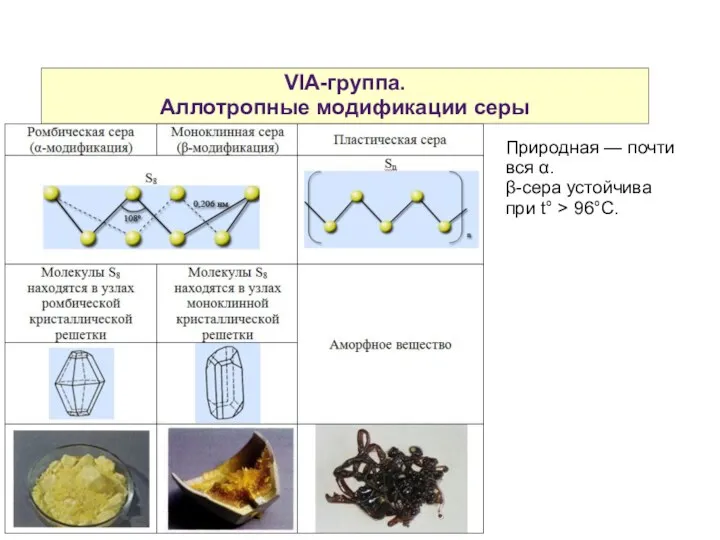
- 8. VIA-группа. Аллотропные модификации серы Природная — почти вся α. β-сера устойчива при t° > 96°C.
- 9. VIA-группа. Сера. Химические свойства. Валентность: II, IV, VI. Степени окисления: -2, (+2), +4, +6. Все Нерастворима
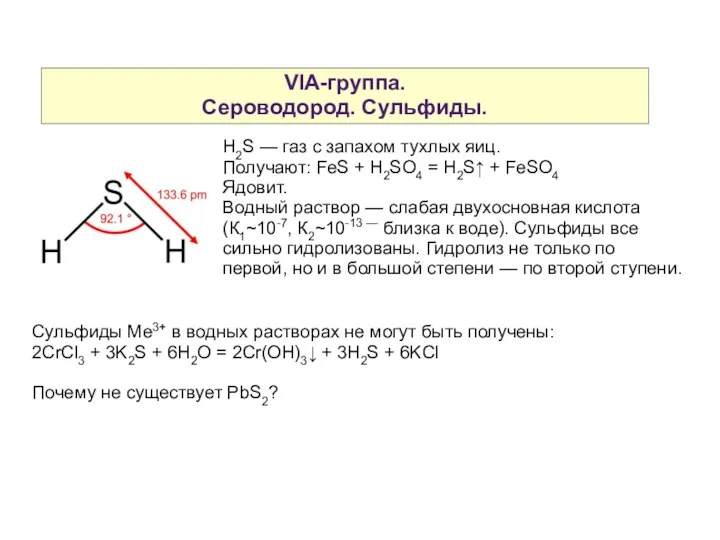
- 10. VIA-группа. Сероводород. Сульфиды. H2S — газ с запахом тухлых яиц. Получают: FeS + H2SO4 = H2S↑
- 11. VIA-группа. Сероводород. Сульфиды. H2S и сульфиды — исключительные восстановители. Окисляются, как правило, до S0. 5H2S +
- 12. VIA-группа. Сероводород. Сульфиды. Классификация сульфидов Растворимые растворимые нерастворимые в воде в минеральных в минеральных K2S кислотах
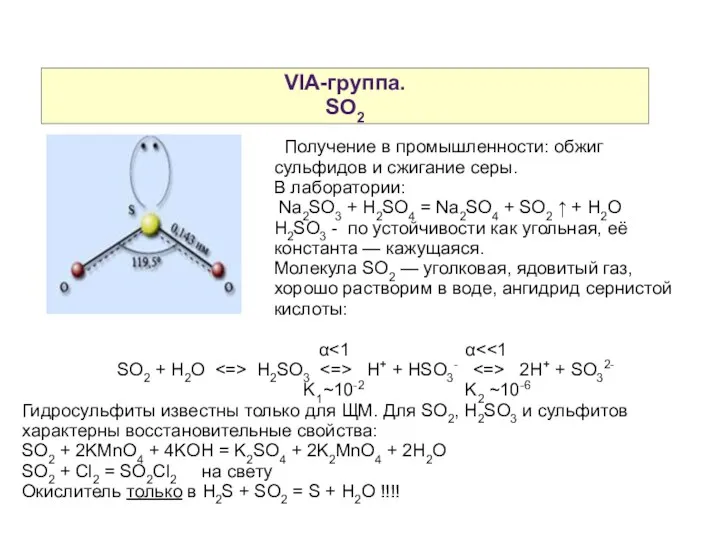
- 13. VIA-группа. SO2 Получение в промышленности: обжиг сульфидов и сжигание серы. В лаборатории: Na2SO3 + H2SO4 =
- 14. VIA-группа. SO2 При хранении сульфиты легко окисляются кислородом воздуха и портятся. Сульфиты и гидросульфиты при нагревании
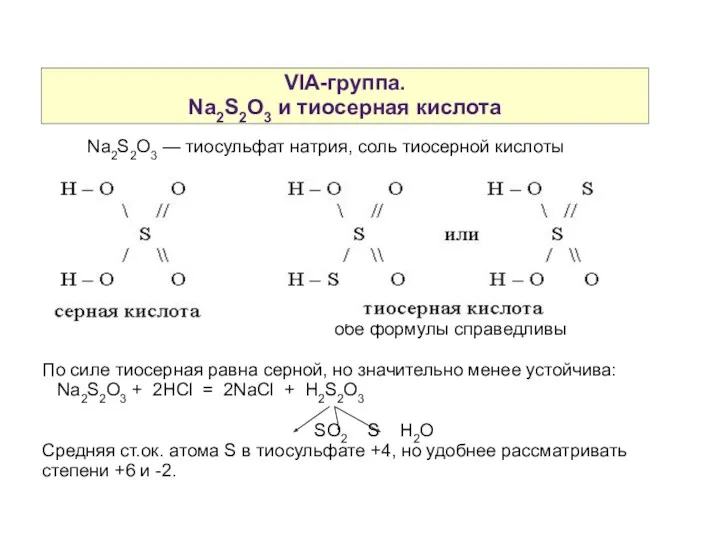
- 15. VIA-группа. Na2S2O3 и тиосерная кислота Na2S2O3 — тиосульфат натрия, соль тиосерной кислоты обе формулы справедливы По
- 16. VIA-группа. Na2S2O3 и тиосерная кислота При недостатке окислителя S2- окисляется до S0, а при избытке —
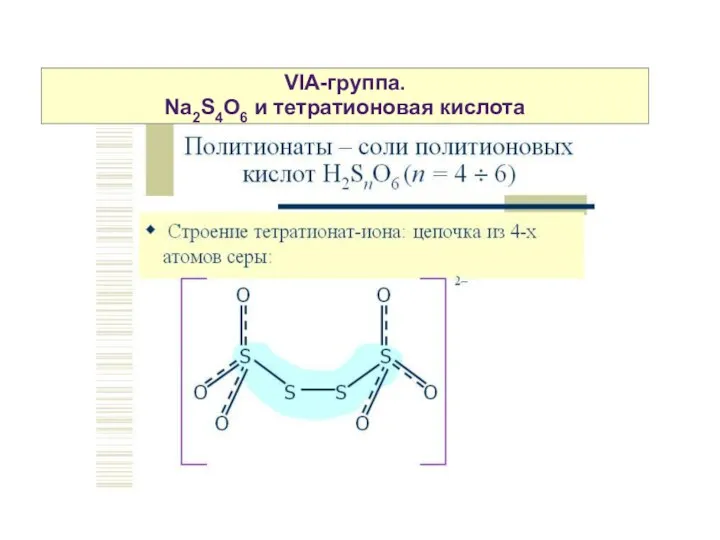
- 17. VIA-группа. Na2S4O6 и тетратионовая кислота
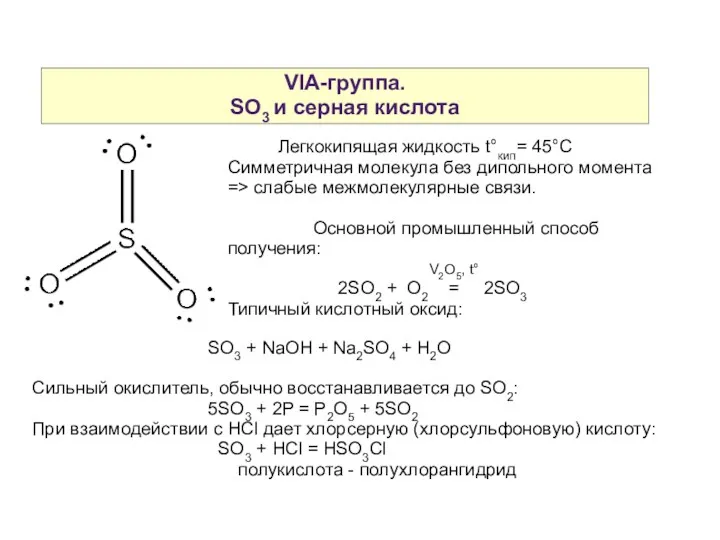
- 18. VIA-группа. SO3 и серная кислота Легкокипящая жидкость t°кип= 45°С Симметричная молекула без дипольного момента => слабые
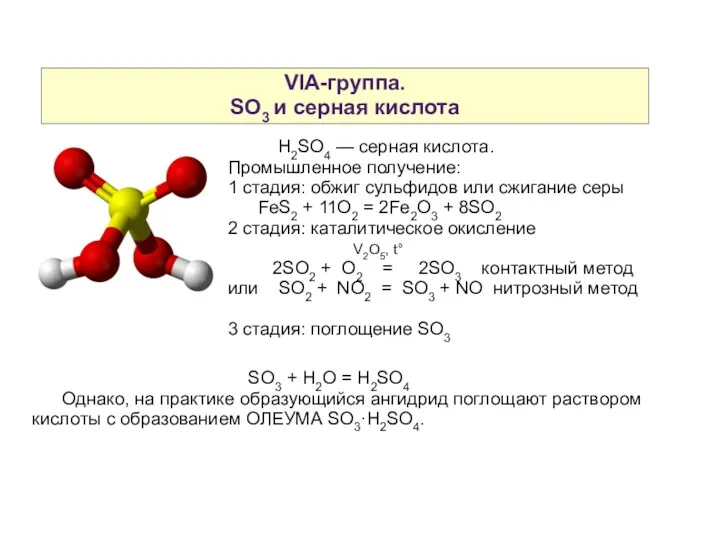
- 19. VIA-группа. SO3 и серная кислота H2SO4 — серная кислота. Промышленное получение: 1 стадия: обжиг сульфидов или
- 20. VIA-группа. SO3 и серная кислота
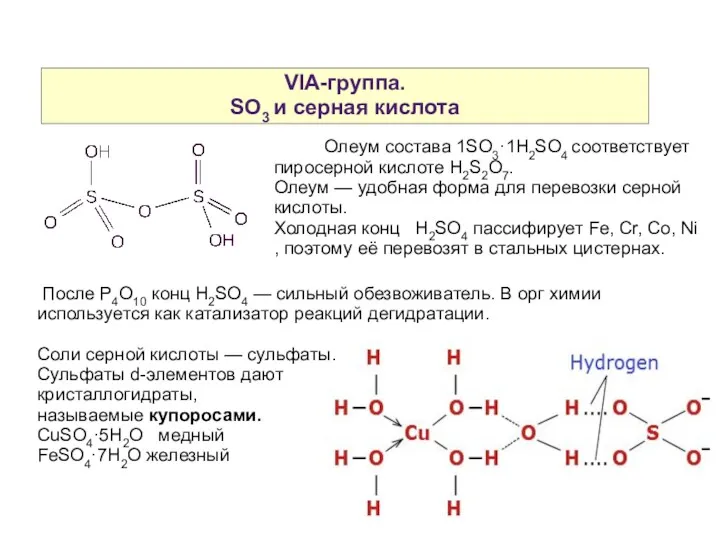
- 21. VIA-группа. SO3 и серная кислота Олеум состава 1SO3·1H2SO4 соответствует пиросерной кислоте H2S2O7. Олеум — удобная форма
- 22. VIA-группа. Селен теллур полоний Основной источник — шламы электролизеров, в которых чистят медь и никель. Примеси
- 23. VIA-группа. Селен, теллур, полоний: химические свойства. Тенденция проявляется своеобразно: Se и Те стремятся перейти не просто
- 24. VIA-группа. Селен, теллур, полоний: химические свойства. H2S H2Se H2Te Рост силы кислот в водном растворе Рост
- 25. VIA-группа. Селен, теллур, полоний: химические свойства. H2SeO4 (селеновая), H6TeО6 (Те(ОН)6 или формально Н2ТеО4 — теллуровая H2SeO4
- 26. VIA-группа. Галогены В природе входят в состав очень многих минералов: Каменная соль Карналлит Плавиковый шпат, флюорит
- 27. VIA-группа. Галогены. Получение. Химические свойства. F2: электролиз расплава KHF2 Cl2: электролиз расплавов и растворов хлоридов ЩМ
- 28. VIA-группа. Галогены. Получение. Химические свойства. F2: при tкомн реагирует со всеми простыми веществами, кроме O2, N2
- 29. VIA-группа. Галогены. Получение. Химические свойства. Равновесие в щелочном растворе сдвигается вправо за счет нейтрализации кислот: Г2
- 30. VIA-группа. Галогены. Соединения. HF и HCl получают: фторид/хлорид + H2SO4(конц, t°) Получение HBr и HI таким
- 31. VIA-группа. Галогенводороды. HF HCl HBr HI 1) снижается термодинамическая устойчивость 2) уменьшается термическая устойчивость 3) возрастает
- 32. VIA-группа. Кислородные кислоты галогенов Галоген в степени окисления +1: галогеноватистые, соли — гипогалогениты. Кислоты малостабильны, известны
- 33. VIA-группа. Кислородные кислоты галогенов Соли — гипогалогениты — более стабильны. В нейтральных растворах не проявляют окислительных
- 34. VIA-группа. Кислородные кислоты галогенов HOCl HOBr HOI Сила кислот уменьшается Окислительная активность уменьшается Образование HOI термодинамически
- 35. VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +5: галогеноватые кислоты, соли — галогенаты. Известны все
- 36. VIA-группа. Кислородные кислоты галогенов Иодноватые кислоты могут содержать разные количества воды и находится в форме: +H2O
- 37. VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +7: галогенные кислоты, соли — пергалогенаты. Известны все
- 38. VIA-группа. Бинарные соединения галогенов Правило: вышестоящий галоген вытесняет нижестоящий из бинарных соединений. А в кислородсодержащих будет
- 40. Скачать презентацию
























 Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Щавелевая кислота
Щавелевая кислота Химическая связь
Химическая связь Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Дистилляция в химической промышленности
Дистилляция в химической промышленности Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Соли
Соли Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Кислородные соединения углерода
Кислородные соединения углерода Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Лекарства дома
Лекарства дома Каменный уголь. Фенол
Каменный уголь. Фенол Коллигативные свойства растворов
Коллигативные свойства растворов Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Адсорбция. Раздел III
Адсорбция. Раздел III Литий. Физические свойства лития
Литий. Физические свойства лития Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Атомы и молекулы
Атомы и молекулы Типы химических реакций
Типы химических реакций