Содержание
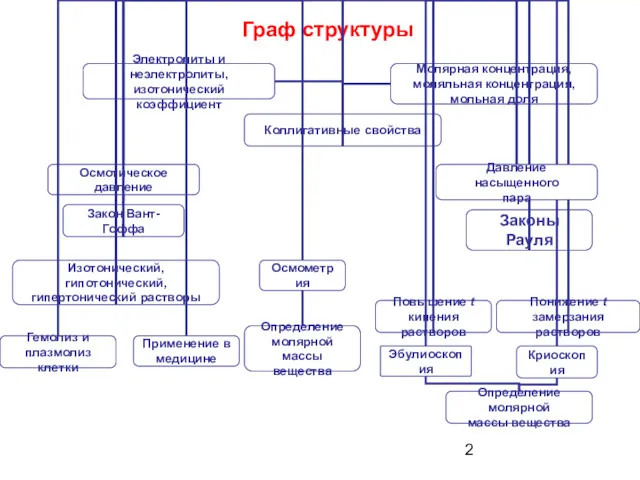
- 2. Граф структуры
- 3. Коллигативные свойства растворов определяются только содержанием частиц растворенного вещества. Понижение давления насыщенного пара растворителя. Повышение температуры
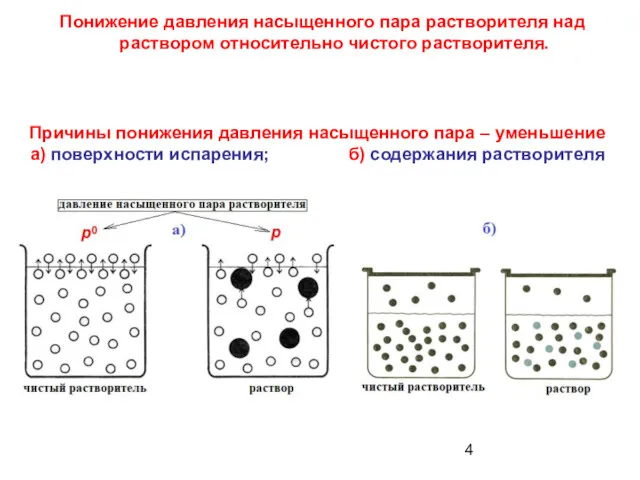
- 4. Понижение давления насыщенного пара растворителя над раствором относительно чистого растворителя. Причины понижения давления насыщенного пара –
- 5. Для разбавленных растворов неэлектролитов, близких к идеальным, коэффициент пропорциональности равен 1. Для растворов электролитов, в которых
- 6. Уравнения I закона Рауля: Физический смысл i – отношение общего числа всех частиц растворенного вещества В
- 7. На I законе Рауля основан один из методов определения молярных масс М (г/моль) нелетучих неэлектролитов:
- 8. При температуре кипения Ткип давление пара над жидкостью равно внешнему давлению. При температуре замерзания (кристаллизации, плавления)
- 9. II закон Рауля: понижение температуры замерзания ΔТзам = Тзам р-ля – Тзам р-ра и повышение температуры
- 10. На II законе Рауля основаны криоскопический и эбулиоскопический методы определения молярных масс М (г/моль) нелетучих неэлектролитов:
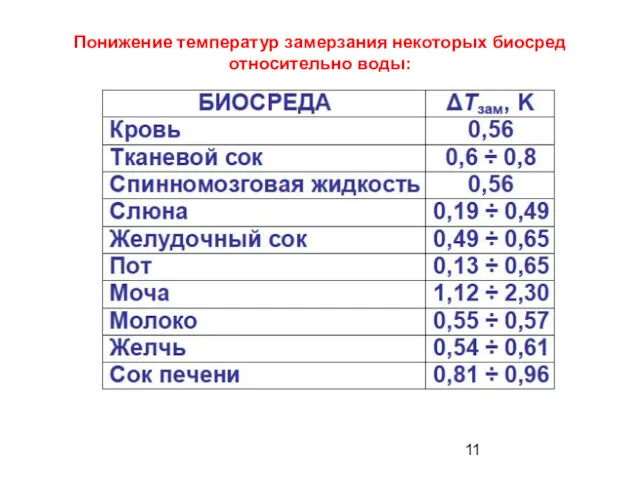
- 11. Понижение температур замерзания некоторых биосред относительно воды:
- 12. неорганические: хлориды аммония, натрия, магния, кальция; карбонат калия. органические: этанол, глицерин, этиленгликоль. Насыщенный раствор хлорида кальция
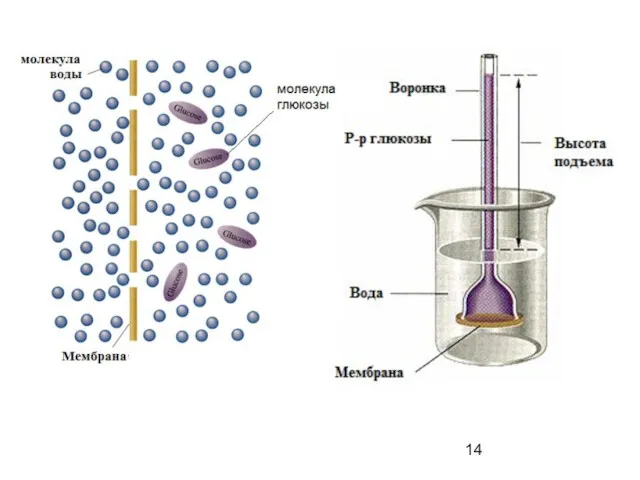
- 13. Осмос и осмотическое давление. Осмос – самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану (перегородку), разделяющую раствор
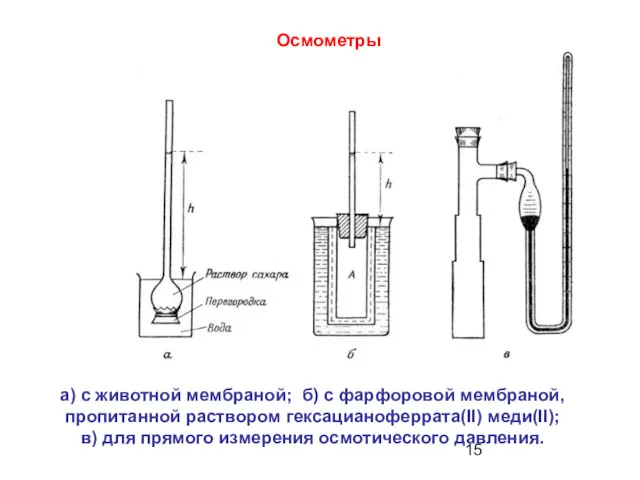
- 15. а) с животной мембраной; б) с фарфоровой мембраной, пропитанной раствором гексацианоферрата(II) меди(II); в) для прямого измерения
- 16. Закон Вант-Гоффа. а) осмотическое давление раствора pосм (π) прямо пропорционально произведению молярной концентрации растворенного вещества c
- 17. Для 1 М раствора неэлектролита при T = 273 К pосм = 2270 кПа = 22,4
- 18. Онкотическое давление – осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма, оно составляет около
- 19. Изотонические – растворы с одинаковым изотоническим давлением. Физиологические растворы 0,89 %-ный (0,15 М) раствор NаСl и
- 20. Нарушение изоосмии губительно для организма. Понижение осмотического давления (избыток воды, потеря солей) вызывает рвоту, судороги, затемнение
- 21. Лизис, гемолиз, плазмолиз. Лизис – разрыв клетки при введении гипотонического по отношению к крови раствора. Гемолиз
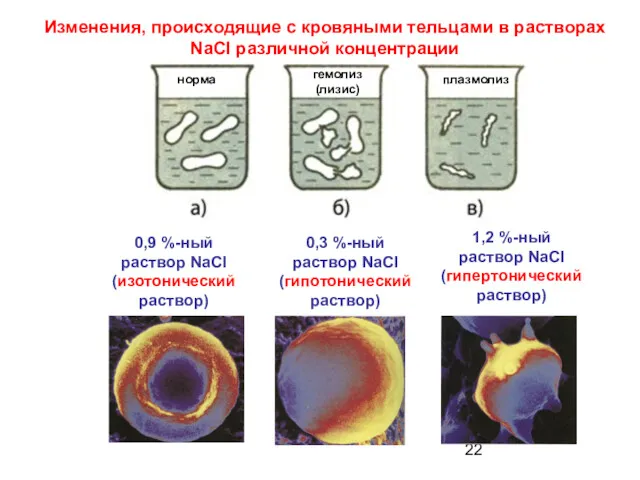
- 22. Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации норма гемолиз (лизис) 0,9 %-ный раствор
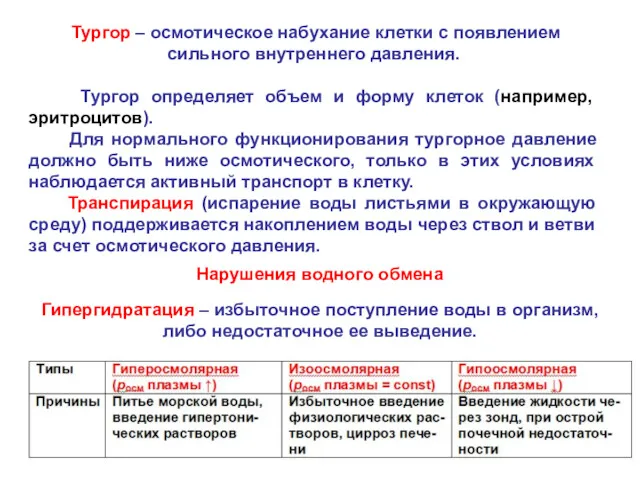
- 23. Тургор – осмотическое набухание клетки с появлением сильного внутреннего давления. Тургор определяет объем и форму клеток
- 24. Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в организм, либо чрезмерных её потерь. При
- 26. 4. При очистке ран от гноя и носителей инфекции используют гипертонические марлевые повязки, пропитанные 10 %-ным
- 28. Скачать презентацию

















 Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Строение атома. Теории строения атома
Строение атома. Теории строения атома Элементы подгруппы углерода
Элементы подгруппы углерода Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Камни и минералы
Камни и минералы Предельные углеводороды
Предельные углеводороды Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи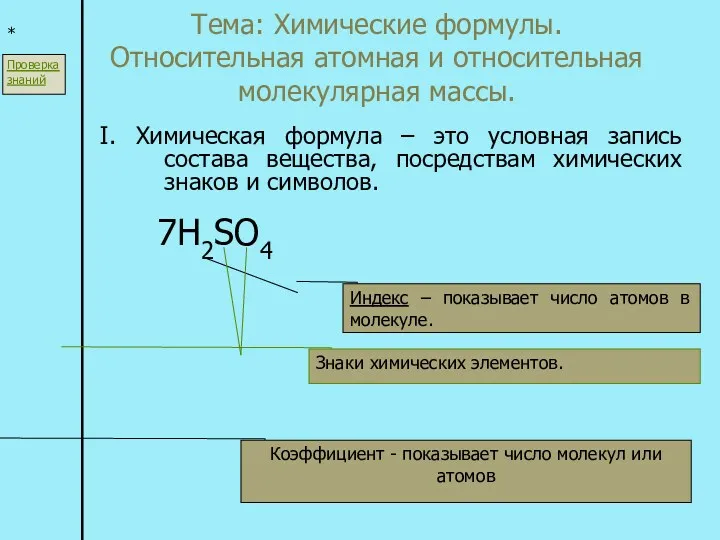 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Водород - топливо будущего
Водород - топливо будущего Углеводороды: предельные и непредельные
Углеводороды: предельные и непредельные Как трудно быть особенной…
Как трудно быть особенной… Alkynes
Alkynes Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Пластмаси та полімери
Пластмаси та полімери Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Общая и медицинская химия
Общая и медицинская химия Дисперсные системы
Дисперсные системы Получение кислот
Получение кислот Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Органическая химия. Пособие
Органическая химия. Пособие Металлы. Свойства металлов
Металлы. Свойства металлов