Содержание
- 2. На сегодняшний день известно 118 химических элементов. Эти элементы образуют огромное количество различных соединений, многие из
- 3. Что мы знаем о химических реакциях? Давайте с вами вспомним 1. Что же такое химические превращения
- 4. 4. Можно ли условно записать химическую реакцию? 5. Что такое химическое уравнение? 6. На основании какого
- 5. Изучение нового материала Никакой, даже самый современный компьютер, не смог бы подсчитать число возможных химических реакций.
- 6. Ржавление железа, окисление резины – примеры медленно протекающих реакций. Взрыв пороха, вспышка паров бензина в двигателе
- 7. Химических реакций известно в мире много И каждая в отдельности важна, я вам скажу. Реакции мы
- 8. 2H2 + O2 = 2H2O CaO + H2O = Ca(OH)2 Cu(OH)2 = CuO + H2O 2HgO
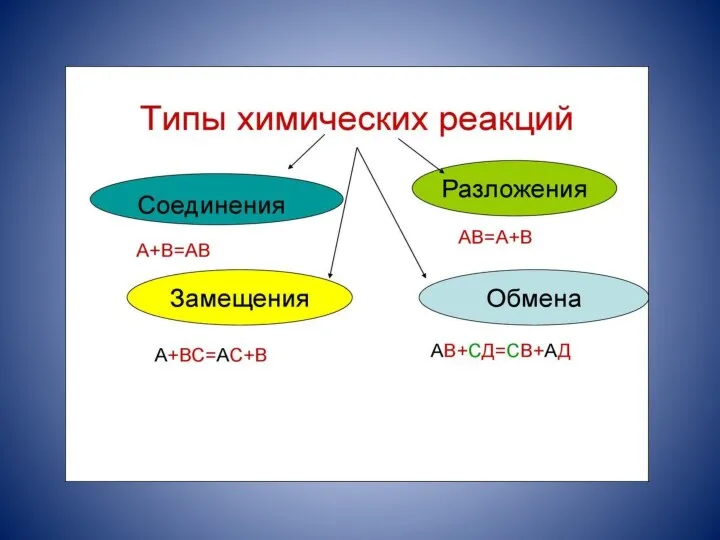
- 10. Реакции соединения Реакции соединения – реакции, в результате которых из двух или нескольких исходных веществ образуется
- 11. Реакции разложения Реакции разложения – реакции, при которых из одного сложного вещества образуется несколько новых веществ.
- 12. Реакции замещения Реакции замещения – реакции между простыми и сложными веществами, в результате которых атомы простого
- 13. Реакции обмена Реакции обмена – реакции между двумя сложными веществами, в результате которых они обмениваются своими
- 15. Скачать презентацию











 Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Рафинирование металлических расплавов
Рафинирование металлических расплавов Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Общая характеристика металлов
Общая характеристика металлов Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Ископаемые углеводороды
Ископаемые углеводороды Времена алхимиков
Времена алхимиков Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI) Минералы для ИЗБ
Минералы для ИЗБ Химия: классификация химических реакций
Химия: классификация химических реакций Химический элемент углерод
Химический элемент углерод Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Термодинамика химических процессов
Термодинамика химических процессов Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер
Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер Химическая кинетика. Тема 2.2
Химическая кинетика. Тема 2.2 Атомы и молекулы. Простые и сложные вещества (8 класс)
Атомы и молекулы. Простые и сложные вещества (8 класс) Растворы. Лекция 7
Растворы. Лекция 7 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Алкадиены (диены)
Алкадиены (диены) Гидролиз солей
Гидролиз солей Галогены
Галогены