низкой электроотрицательностью. Металлы имеют металлическую кристаллическую решетку(кристаллическая решетка, в узлах которой находятся положительные ионы металлов, окруженные относительно свободными электронами, движущимися по всему объему кристалла).
Имеют металлический блеск
Агрегатное состояние – твердое (кроме ртути)
По цвету разделяют: черные металлы и цветные металлы
У многих большая теплопроводность – т.е. металлы – хорошие проводники электрического тока
Многие из пластичны, ковкие (меняют свою форму)
Имеют разные температуры плавления: разделяют легкоплавкие и тугоплавкие металлы
Металлы по плотности бывают легкие и тяжелые
Металлы могут быть мягкими (например - калий, литий, натрий – они режутся ножом и твердыми (например - хром, которым можно резать стекло)
Физические свойства
 Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Олигомеризация олефинов
Олигомеризация олефинов Основні класи неорганічних сполук
Основні класи неорганічних сполук Коллоидная химия
Коллоидная химия Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Тема. Водородная связь
Тема. Водородная связь ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ Дисперсные (коллоидные) системы и растворы
Дисперсные (коллоидные) системы и растворы Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Проект Кабинет химии будущего
Проект Кабинет химии будущего Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Подгруппа Азота
Подгруппа Азота Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Алкадиены
Алкадиены Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері Установка производства серы по методу Клауса
Установка производства серы по методу Клауса Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Кристаллические решетки
Кристаллические решетки Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс)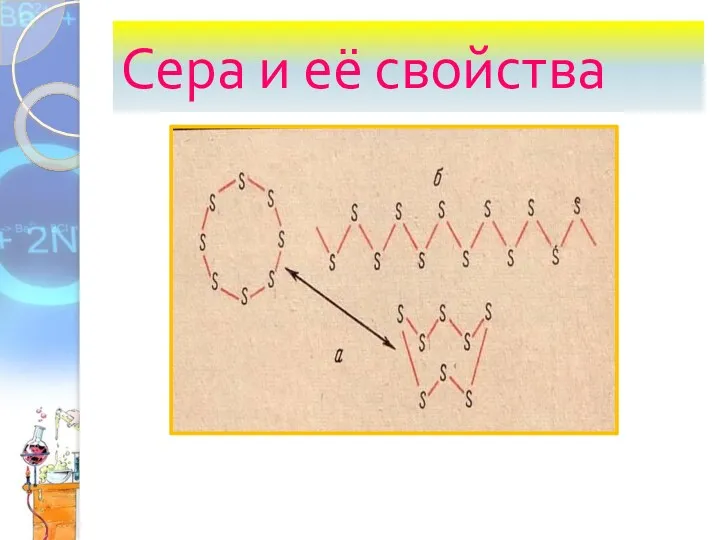 Сера и её свойства
Сера и её свойства Задачи на растворы
Задачи на растворы Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям
Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям