Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям презентация
Содержание
- 2. План 1. Теория сильных электролитов. 2. Закон действующих масс. Константа равновесия. 3. Гетерогенные равновесия в системе
- 3. Теория сильных электролитов Дебая- Хюккеля Активность (а) - это мера реального поведения вещества в растворе. Ее
- 4. Для равновесной химической реакции: aA + bB ⮀ cC + dD Скорость прямой реакции: V1 =
- 6. где - активности исходных веществ А и В и продуктов реакции С и D.
- 7. Для электролита КnАm ↔ nКm+ + mАn-
- 8. Концентрационное произведение растворимости: ПРс = [Кm +]n ∙ [А n-]m
- 9. Для BaSO4 – электролита однотипного состава (бинарного электролита)
- 10. Для Cа3(РО4)2 – электролита неоднотипного состава
- 11. Для бинарных электролитов: Для любых осадков: ПР = mm ∙ nn ∙ Pm+n
- 15. Природа осадка: ПРPbSO4 = 1,6∙10-8 ПРPbCl2 = 1,6∙10-5 ПРPbCO3 = 7,5∙10-14
- 16. Пример. Вычислите, во сколько раз растворимость (в г/л) карбоната марганца(II) в чистой воде превышает растворимость этой
- 17. Ps= 3,6.10-10 . 114,95 = 4,14 . 10-8 г/л
- 18. Пример. Вычислите, во сколько раз растворимость сульфита кальция в чистой воде меньше растворимости его в 0,1
- 19. ПР СaSO4(в воде) = 2,5· 10-5 ПР СaSO4(в этаноле) = 10-10
- 20. ПР CaSO4 = 2,5∙10-5; ПР ВaSO4 = 1,0∙10-10
- 21. ПР ВaSO4 = [Ba2+]∙[SO42-] = 1,0∙10-10 ; [SO42-] = 2,5.10-3 моль/л
- 22. СaSO4↓ + Na2СО3 ↔ СaСО3↓ + Na2SO4
- 24. Скачать презентацию






![Концентрационное произведение растворимости: ПРс = [Кm +]n ∙ [А n-]m](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/415969/slide-7.jpg)












![ПР ВaSO4 = [Ba2+]∙[SO42-] = 1,0∙10-10 ; [SO42-] = 2,5.10-3 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/415969/slide-20.jpg)

 Железо как химический элемент
Железо как химический элемент Химические реакторы
Химические реакторы Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях
Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях Термохімічні рівняння
Термохімічні рівняння Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Фракционная перегонка нефти
Фракционная перегонка нефти Химия. D-элементтер
Химия. D-элементтер Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Застосуванння електролiзу
Застосуванння електролiзу Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Углекислый газ
Углекислый газ Изомеры и гомологи
Изомеры и гомологи Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях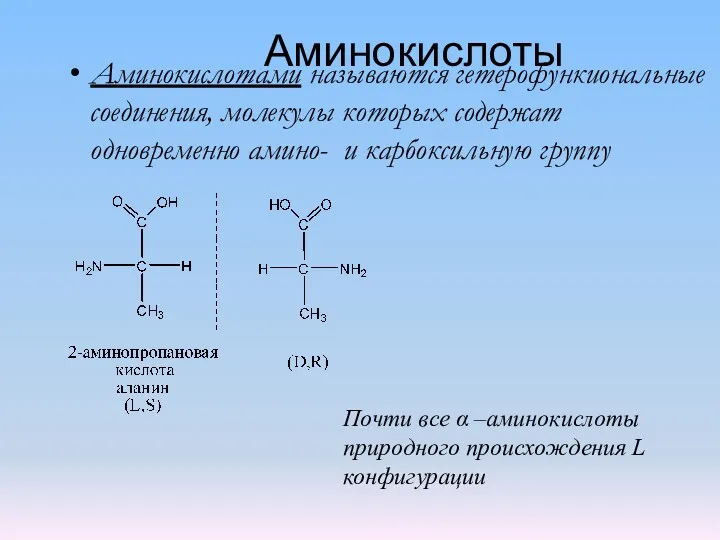 Аминокислоты 1
Аминокислоты 1 Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Мембранное материаловедение
Мембранное материаловедение Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Химические свойства металлов
Химические свойства металлов Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Амин қышқылдар
Амин қышқылдар Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Обезвреживающая функция печени
Обезвреживающая функция печени Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота