Содержание
- 2. ПЛАН: I. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. II. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА.
- 3. I. КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. Периодической системы Д.И. Менделеева. Атомный номер 26, атомная
- 4. II. НАХОЖДЕНИЕ В ПРИРОДЕ В земной коре железо распространено достаточно широко. На его долю приходится: Около
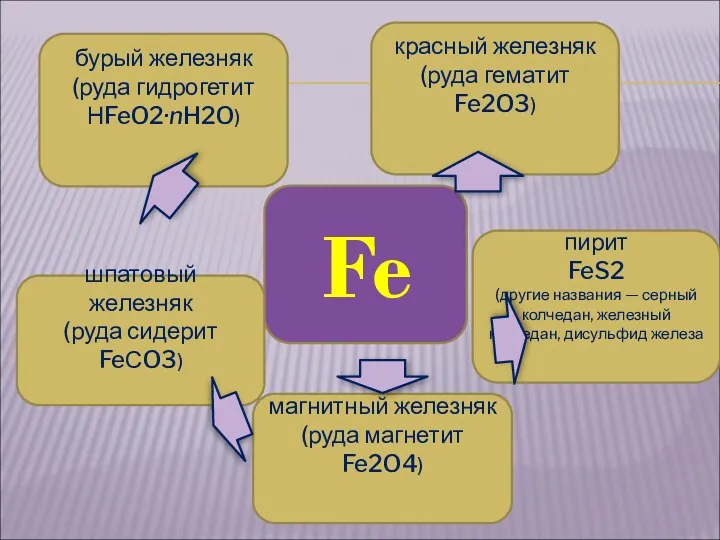
- 5. Fe красный железняк (руда гематит Fe2O3) магнитный железняк (руда магнетит Fe2O4) бурый железняк (руда гидрогетит НFeO2·nH2O)
- 6. КРАСНЫЙ ЖЕЛЕЗНЯК (РУДА ГЕМАТИТ Fe2O3) БУРЫЙ ЖЕЛЕЗНЯК (РУДА ГИДРОГЕТИТ НFEO2 · NH2O)
- 7. ШПАТОВЫЙ ЖЕЛЕЗНЯК (РУДА СИДЕРИТ FEСO3) магнитный железняк (руда магнетит Fe2O4)
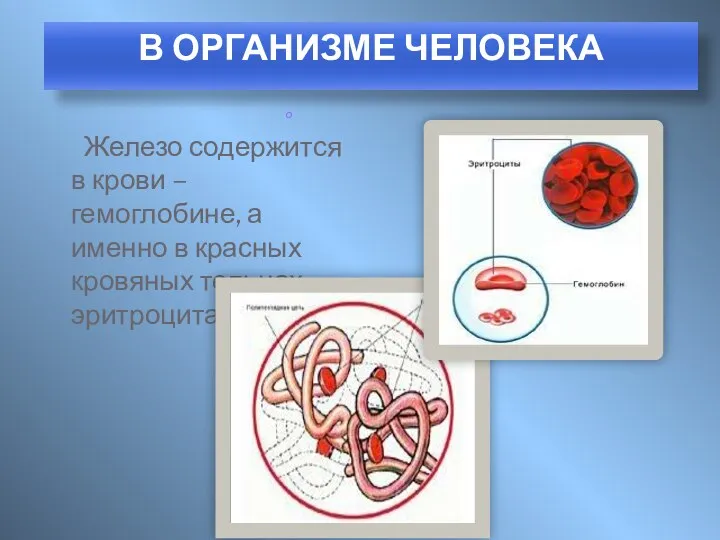
- 8. Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах. о В
- 9. Железо влияет на процесс фотосинтеза. В РАСТЕНИЯХ
- 10. Из железа изготавливают различные виды транспорта В БЫТУ ЧЕЛОВЕКА
- 11. В ВОЕННОЙ ПРОМЫШЛЕННОСТИ
- 12. В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т.
- 13. Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения около 2800
- 14. Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один
- 15. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2
- 16. 3. Взаимодействие с простыми веществами: 3.1 Горит в кислороде 3 Fe + 2 O2 =Fe3 O4
- 17. 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4
- 18. 6. С КИСЛОТАМИ: С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей
- 19. 7. ОКИСЛЕНИЕ ЖЕЛЕЗА При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4FeCl2 +
- 20. ОКСИД ЖЕЛЕЗА 1. Проявляет основные свойства, взаимодействуя с кислотами: FeO+H2SO4 = FeSO4 + H2O 2. Оксид
- 21. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ИОНЫ FE2+ И FE3+. FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe
- 22. Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но
- 24. Скачать презентацию



















 Электролитическая диссоциация
Электролитическая диссоциация Синтез нуклеотидов
Синтез нуклеотидов Строение атома. 8 класс
Строение атома. 8 класс Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Атомы, молекулы и ионы
Атомы, молекулы и ионы Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Нефть. Лекция 5
Нефть. Лекция 5 Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Серная кислота
Серная кислота Дисперсные системы
Дисперсные системы Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Хімічний елемент Літій
Хімічний елемент Літій Углеводороды ациклические, циклические
Углеводороды ациклические, циклические Классификация химических элементов
Классификация химических элементов Механизмы реакций органических соединений
Механизмы реакций органических соединений Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Химия и продукты питания
Химия и продукты питания Кристаллические решетки
Кристаллические решетки Азот қышқылы
Азот қышқылы Общие свойства металлов
Общие свойства металлов Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток