Содержание
- 2. 1)Обобщить сведения о различных видах химических связей и типах кристаллических решеток. 2)Повторить схемы образования веществ с
- 3. Благородные газы-элементы 8 гр.главной подгруппы. He, Ne, Ar, Kr, Xe, Rn –одноатомны 1s2 ns2 np 6
- 4. ИОННАЯ МЕТАЛЛИЧЕСКАЯ КОВАЛЕНТНАЯ (ПОЛЯРНАЯ И НЕПОЛЯРНАЯ) ВОДОРОДНАЯ Химическая связь – это такое взаимодействие ато- мов,которое связывает
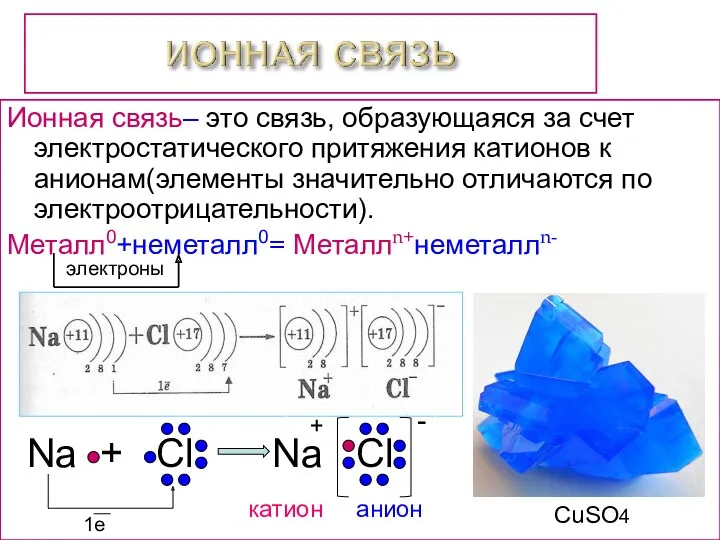
- 5. - Na + Cl Na Cl Ионная связь– это связь, образующаяся за счет электростатического притяжения катионов
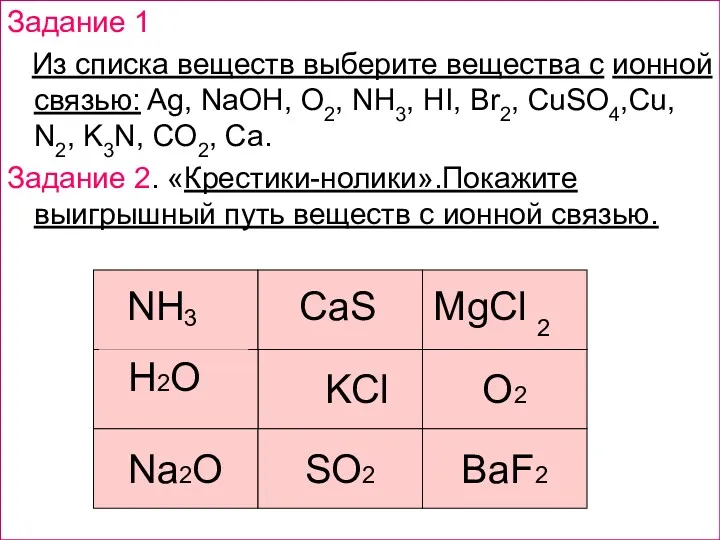
- 6. Задание 1 Из списка веществ выберите вещества с ионной связью: Ag, NaOH, O2, NH3, HI, Br2,
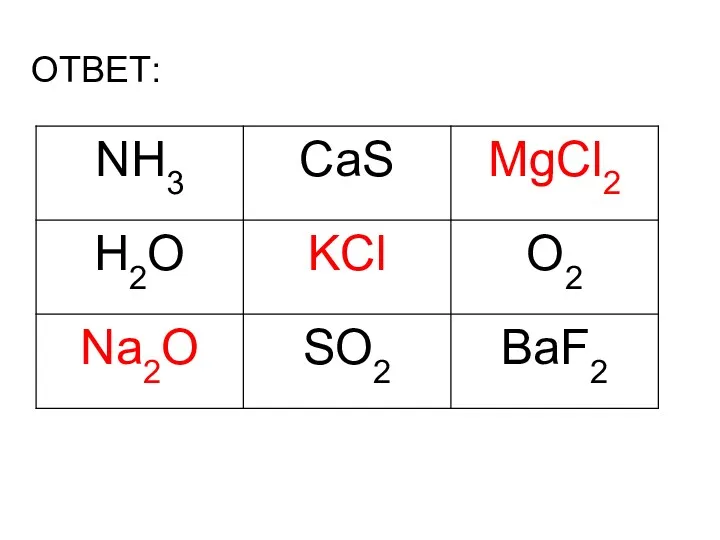
- 7. ОТВЕТ:
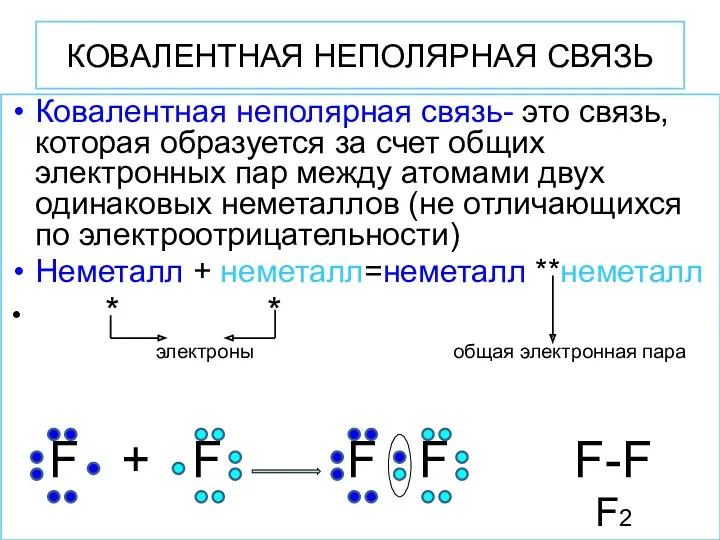
- 8. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ Ковалентная неполярная связь- это связь, которая образуется за счет общих электронных пар между
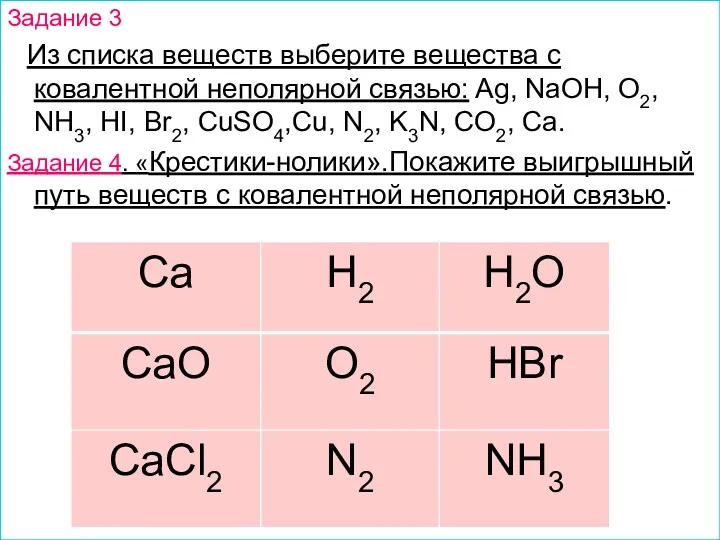
- 9. Задание 3 Из списка веществ выберите вещества с ковалентной неполярной связью: Ag, NaOH, O2, NH3, HI,
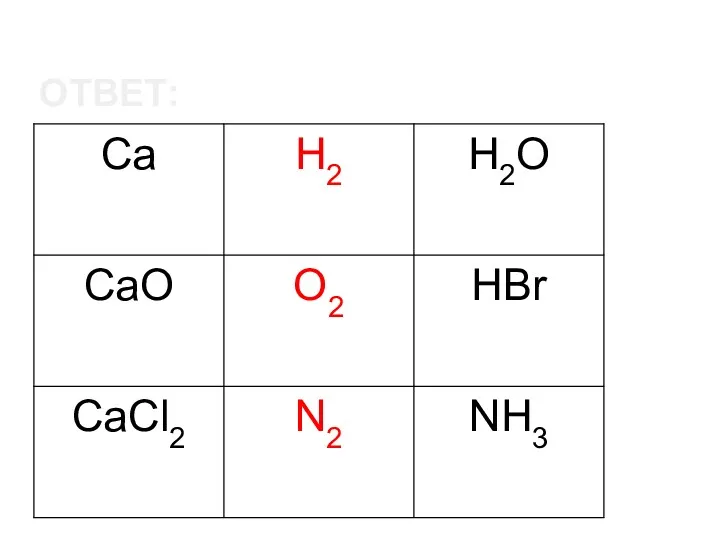
- 10. ОТВЕТ:
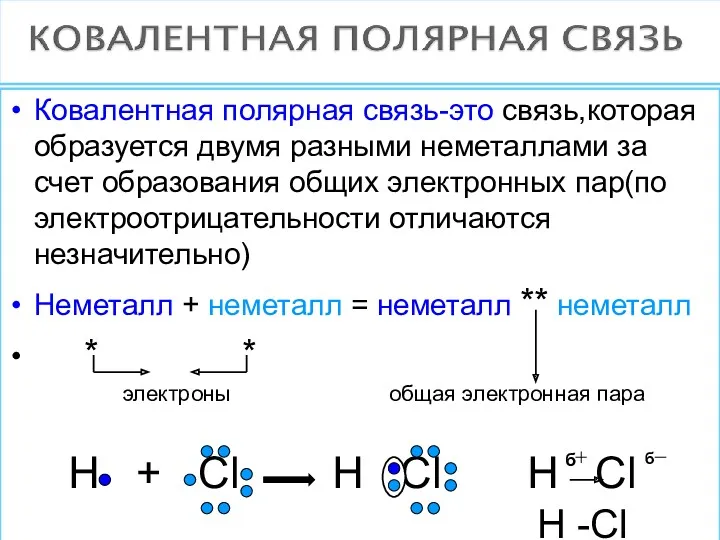
- 11. Ковалентная полярная связь-это связь,которая образуется двумя разными неметаллами за счет образования общих электронных пар(по электроотрицательности отличаются
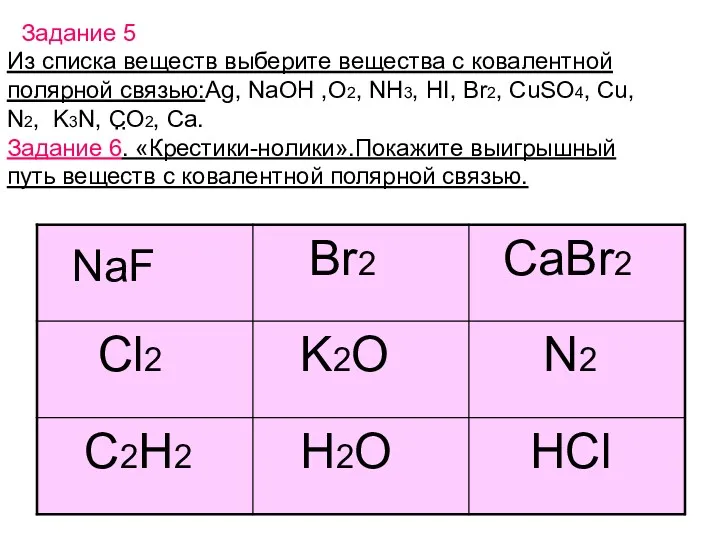
- 12. Из списка веществ выберите вещества с ковалентной полярной связью:Ag, NaOH ,O2, NH3, HI, Br2, CuSO4, Cu,
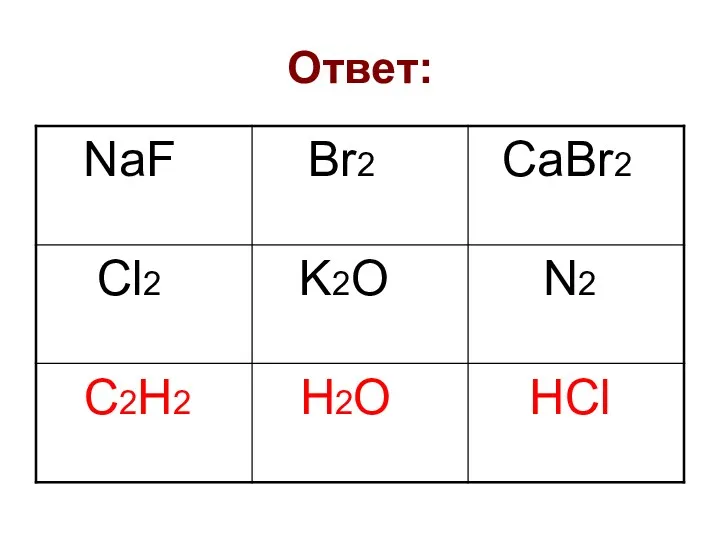
- 13. Ответ:
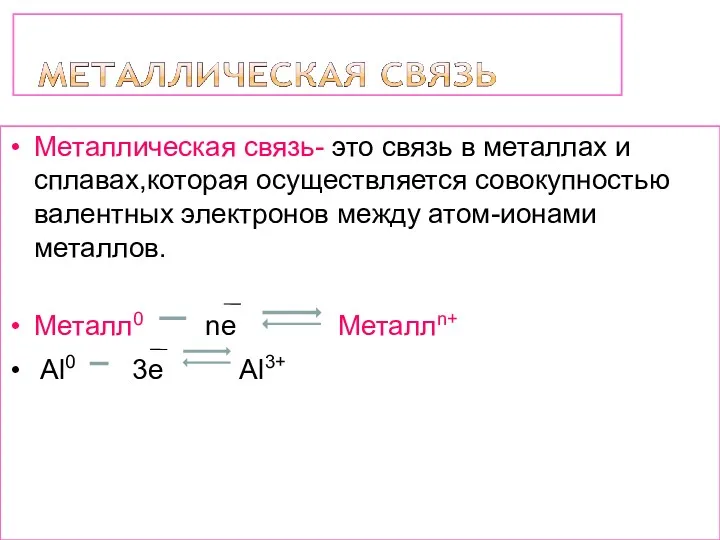
- 14. Металлическая связь- это связь в металлах и сплавах,которая осуществляется совокупностью валентных электронов между атом-ионами металлов. Металл0
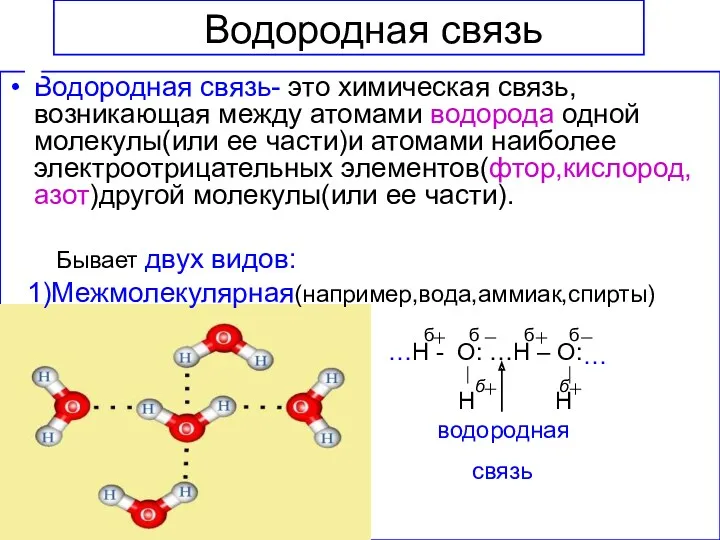
- 15. Водородная связь Водородная связь- это химическая связь,возникающая между атомами водорода одной молекулы(или ее части)и атомами наиболее
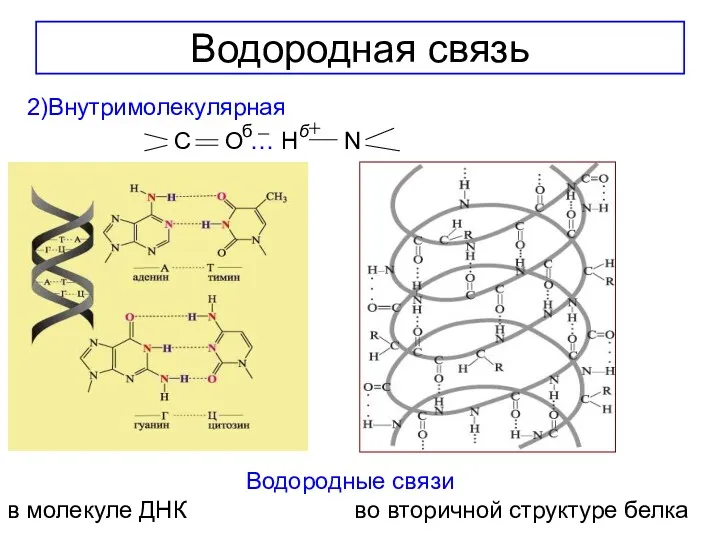
- 16. Водородная связь 2)Внутримолекулярная C O … H N б б Водородные связи в молекуле ДНК во
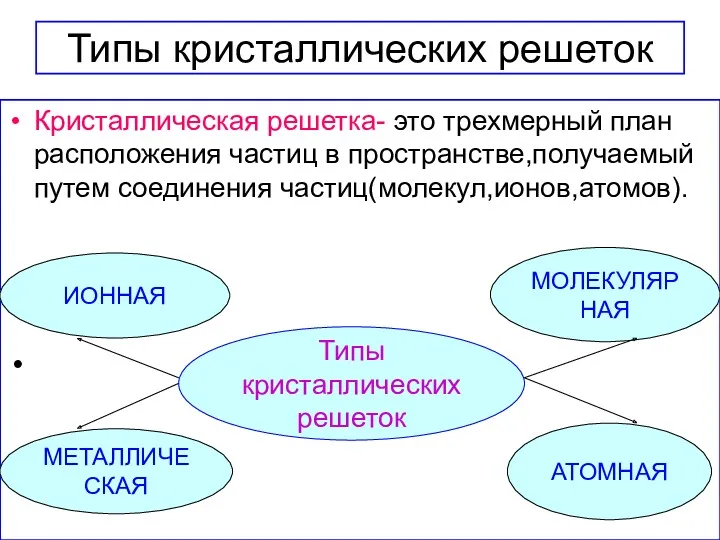
- 17. Типы кристаллических решеток Кристаллическая решетка- это трехмерный план расположения частиц в пространстве,получаемый путем соединения частиц(молекул,ионов,атомов). Типы
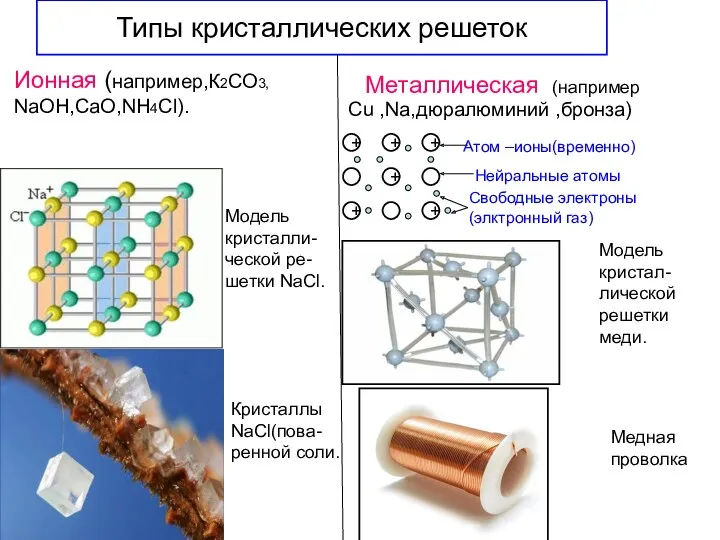
- 18. Типы кристаллических решеток Металлическая Ионная (например,К2СО3, NaOH,СаО,NH4Cl). (например Cu ,Na,дюралюминий ,бронза) Модель кристалли- ческой ре- шетки
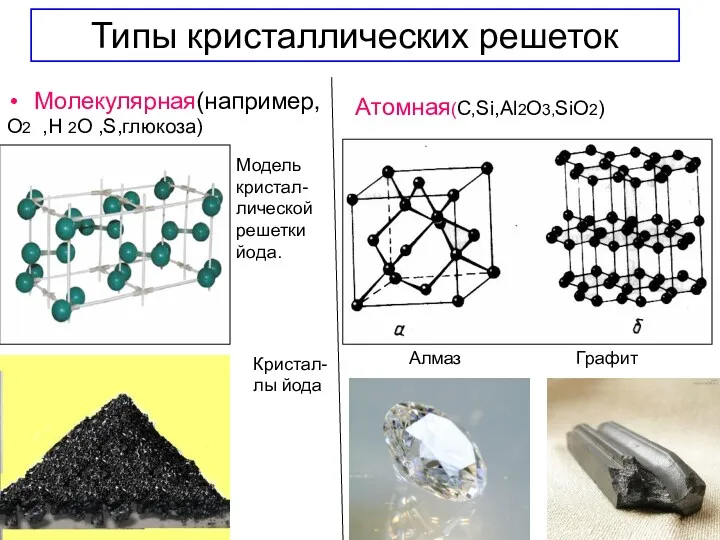
- 19. Типы кристаллических решеток Молекулярная(например, О2 ,Н 2О ,S,глюкоза) Модель кристал- лической решетки йода. Кристал- лы йода
- 20. Задание 7: Загадки.Отгадайте,о каких кристаллических решетках(к.р.) идет речь? 1)И прочностью своей они свой горды- Но только
- 21. Сравнение различных видов химических связей Сходство:1)физическая природа всех видов связей –электронно- ядерное взаимодействие,сопровожда- ющееся выделением энергии.
- 23. Скачать презентацию




 Белки. Строение и свойства
Белки. Строение и свойства Признаки химических реакций
Признаки химических реакций Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7)
Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7) Корбонаттар көмір қышқылынның тұздары
Корбонаттар көмір қышқылынның тұздары Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Обмоточные провода
Обмоточные провода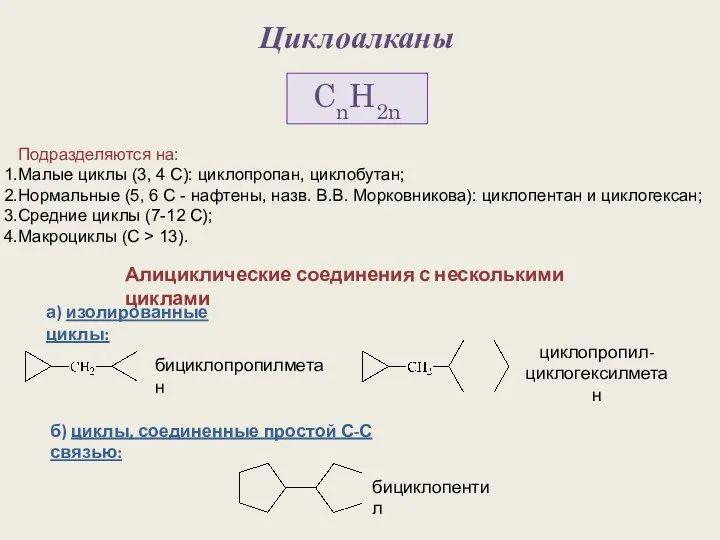 Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов Круговорот воды в природе
Круговорот воды в природе Свойства воды
Свойства воды 20230205_metally_pobochnyh_podgrupp
20230205_metally_pobochnyh_podgrupp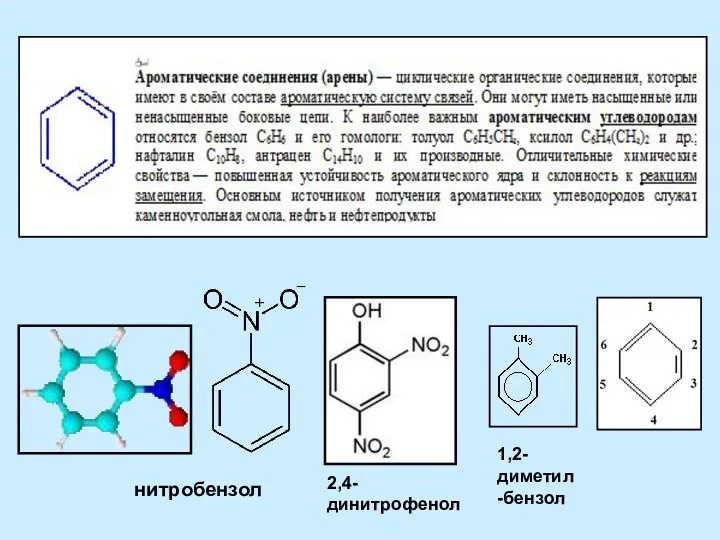 Ароматические соединения (арены)
Ароматические соединения (арены) Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Диаграмма железо-углерод
Диаграмма железо-углерод Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Аммиак
Аммиак Периодическая система химических элементов Д.И. Менделеева. Игра
Периодическая система химических элементов Д.И. Менделеева. Игра Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Химическая взрывчатка
Химическая взрывчатка 20230816_himiya_spirty
20230816_himiya_spirty Выращивание кристаллов
Выращивание кристаллов Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Значение органической химии в жизни человека
Значение органической химии в жизни человека Побутові хімікати
Побутові хімікати Аммиак
Аммиак Биологическая химия с основами физической и коллоидной химии
Биологическая химия с основами физической и коллоидной химии Типы химических реакций
Типы химических реакций Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған