Содержание
- 2. Металлы побочных подгрупп Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы -
- 3. Общая характеристика d- элементов Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По
- 4. Общая характеристика d- элементов d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность
- 5. Химические свойства Электроотрицательность металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает,
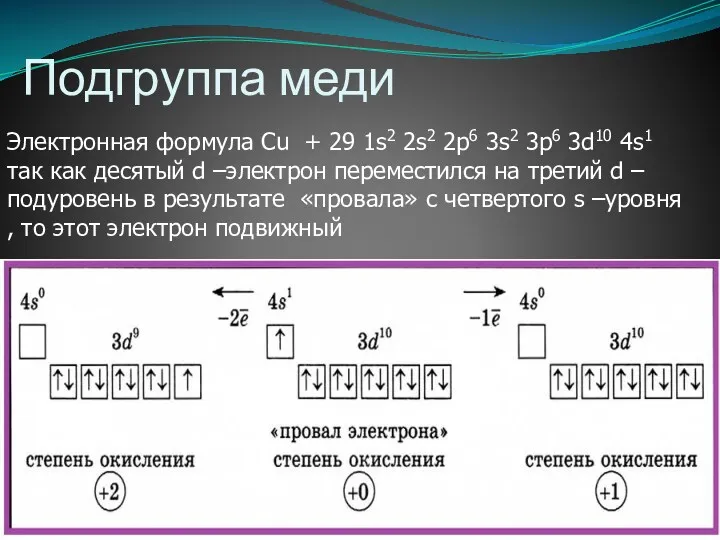
- 6. Подгруппа меди Электронная формула Cu + 29 1s2 2s2 2p6 3s2 3p6 3d10 4s1 так как
- 7. Нахождение меди в природе Встречается в связанном виде и входит в состав соединений : Медный блеск
- 8. Получение меди Получают из медного блеска: 2 Сu2 S+ 3 O2= 2 Cu2 O + 2
- 9. Физические свойства меди Цвет – светло –розовый Тягучая Вязкая Пластичная Хороший проводник электрического тока (уступает только
- 10. Химические свойства меди 1. Взаимодействие с простыми веществами ( с хлором, кислородом и серой- напишите уравнения
- 11. Подгруппа цинка Электронная формула Zn + 30 1s2 2s2 2 p 6 3s2 3p6 3d10 4s2
- 12. Физические свойства цинка Цвет –голубовато –серебристый При обычной температуре –хрупкий При 100 -150 градусах хорошо прокатывается
- 13. Химические свойства цинка На воздухе устойчив, так как покрывается тонким слоем оксида предохраняющего его от дальнейшего
- 14. Подгруппа хрома Электронная конфигурация Cr + 24 1s 2 2s 2 2p6 3s2 3p6 3d5 4s2
- 15. Подгруппа хрома. Физические свойства хрома. Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С В
- 16. Подгруппа хрома. Физические свойства хрома. Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С В
- 17. Химические свойства хрома I. Взаимодействие с простыми веществами (при н.у. хром реагирует только со фтором) При
- 18. Химические свойства хрома II. Взаимодействие со сложными веществами 1. В раскалённом состоянии реагирует с парами воды:
- 19. Подгруппа железа Степени окисления железа +2 +3 но имеются также и соединения в которых железо проявляет
- 20. Железо Металл средней активности, восстановитель: Fe0-2e-→Fe+2, окисляется восстановитель Fe0-3e-→Fe+3, окисляется восстановитель Железо – один из самых
- 21. Нахождение железа в природе Основными железными рудами являются: магнетит (магнитный железняк) – Fe3O4 содержит 72% железа,
- 22. . Физические свойства железа Серебристо-белый металл с температурой плавления 1539оС. Очень пластичный (куется, прокатывается, штампуется. Намагничивается
- 23. Химические свойства железа 1) На воздухе железо легко окисляется в присутствии влаги (ржавление): 4Fe + 3O2
- 24. Химические свойства железа 3) При высокой температуре (700–900°C) железо реагирует с парами воды: 3Fe + 4H2O
- 25. Химические свойства железа 5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
- 26. Химические свойства железа Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
- 28. Скачать презентацию
























 Основные понятия. Химический язык
Основные понятия. Химический язык Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)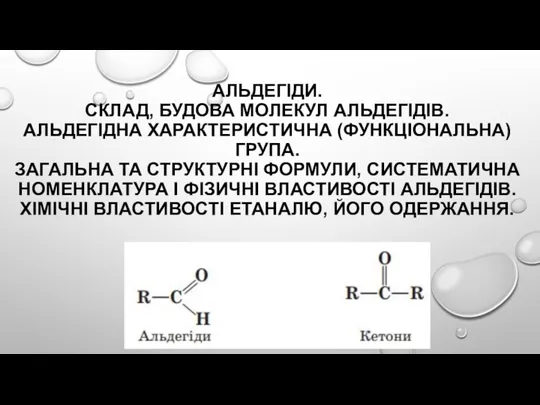 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Оксиди нітрогену
Оксиди нітрогену Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Алкадиены
Алкадиены Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Білки (протеїни)
Білки (протеїни) Строение и свойства материалов
Строение и свойства материалов Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов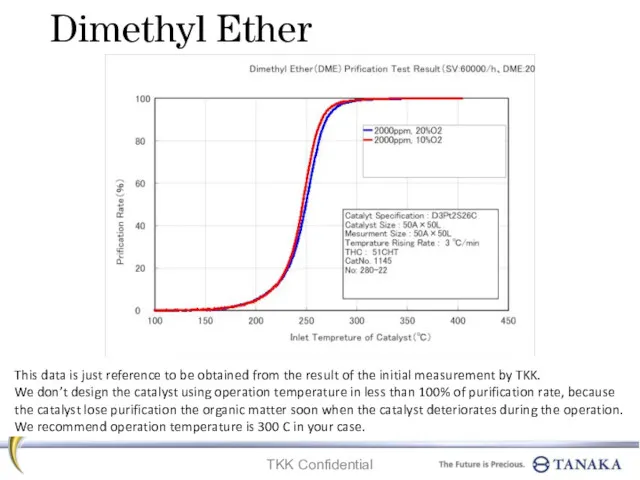 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Озон. Строние молекулы озона
Озон. Строние молекулы озона Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля