Содержание
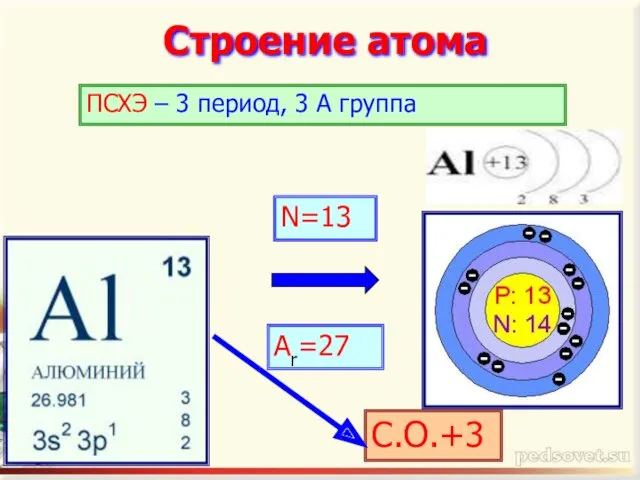
- 2. Строение атома N=13 Ar=27 ПСХЭ – 3 период, 3 А группа С.О.+3
- 3. Алюминий – самый распространенный в природе элемент, по содержанию в земной коре (8%) находится на третьем
- 4. Нахождение в природе Бокситы – Al2O3 • H2O Нефелины – KNa3[AlSiO4]4 Глиноземы - Al2O3 Be3Al2Si6O18 Берилл
- 5. Рубин Сапфир Al2O3 корунд
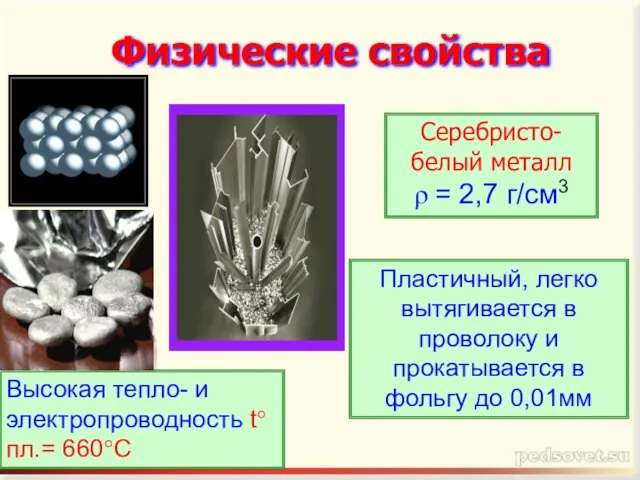
- 6. Физические свойства Серебристо-белый металл ρ = 2,7 г/см3 Высокая тепло- и электропроводность t°пл.= 660°C Пластичный, легко
- 7. Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид
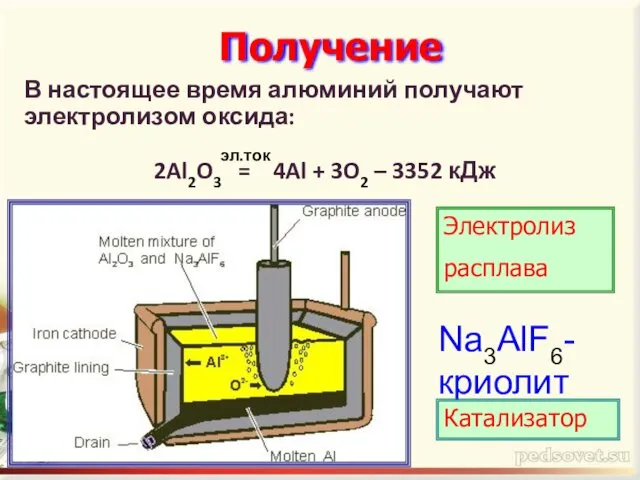
- 8. Получение Электролиз расплава Na3AlF6- криолит Катализатор В настоящее время алюминий получают электролизом оксида: эл.ток 2Al2O3 =
- 9. Химические свойства Al – покрыт прочной оксидной пленкой Al2О3, защищающей металл от дальнейшего окисления и обусловливающей
- 10. 2Al0 + 3S0 –t°→ Al2+3S3 2Al0 + N20 –t°→ 2Al+3N 4Al0 + 3С0 –t°→ Al4+3С3 Сульфид
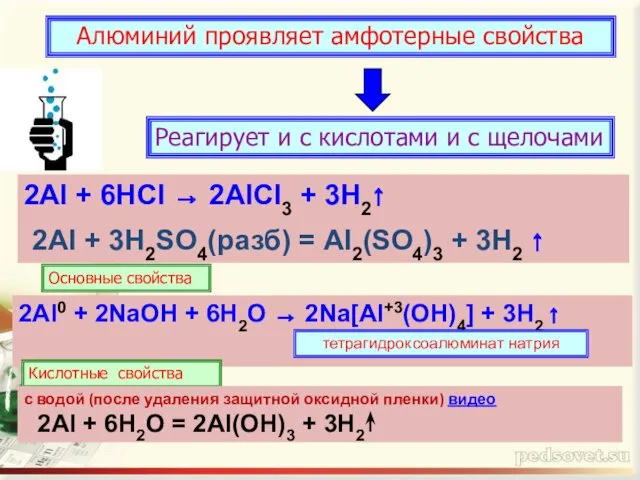
- 11. Алюминий проявляет амфотерные свойства Реагирует и с кислотами и с щелочами 2Al + 6HCl → 2AlCl3
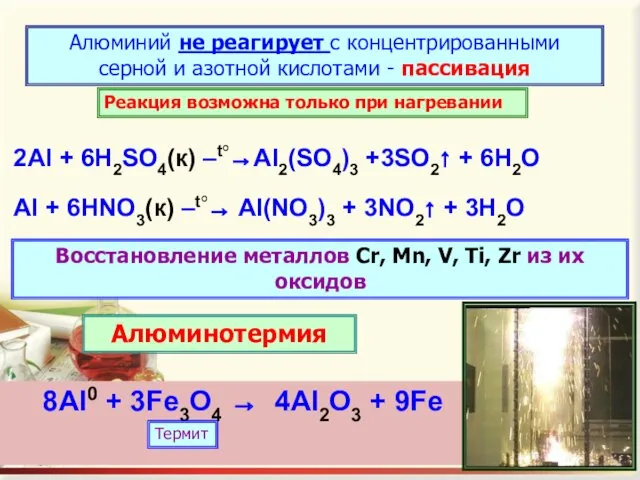
- 12. Алюминий не реагирует с концентрированными серной и азотной кислотами - пассивация 2Al + 6H2SO4(к) –t°→Al2(SO4)3 +3SO2↑
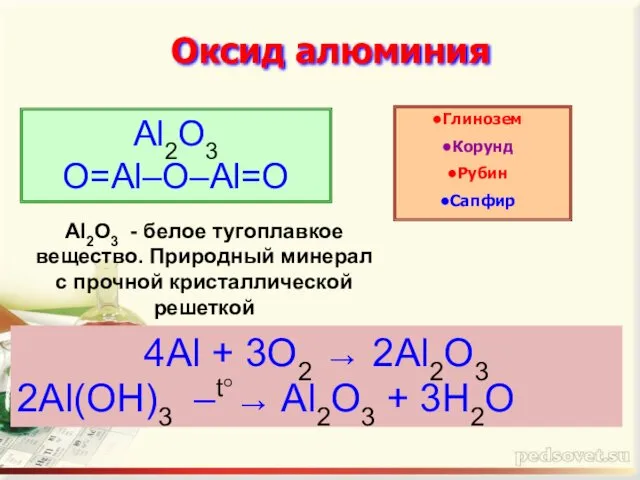
- 13. Оксид алюминия Al2O3 O=Al–O–Al=O Глинозем Корунд Рубин Сапфир 4Al + 3O2 → 2Al2O3 2Al(OH)3 –t°→ Al2O3
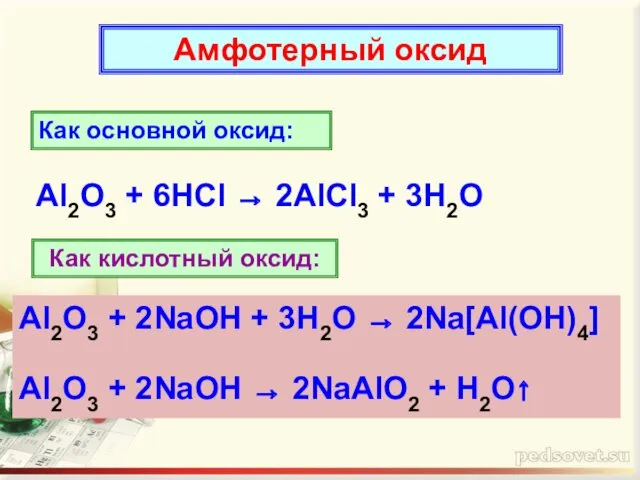
- 14. Амфотерный оксид Как основной оксид: Al2O3 + 6HCl → 2AlCl3 + 3H2O Как кислотный оксид: Al2O3
- 15. Гидроксид алюминия Al(OH)3 AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl Гидроксид алюминия Al(OН)3 – белое, кристаллическое
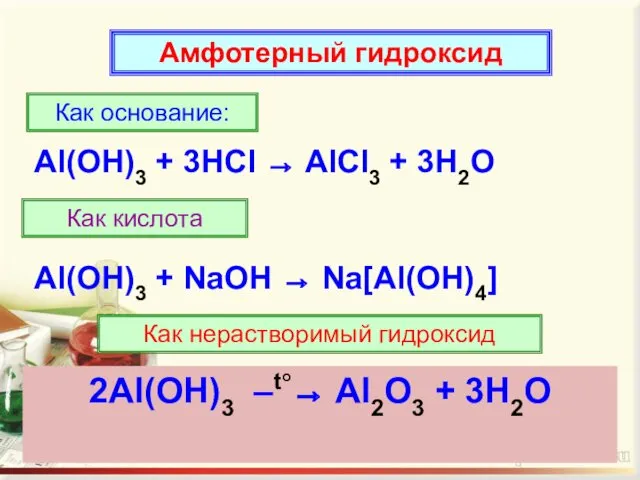
- 16. Амфотерный гидроксид Как основание: Al(OH)3 + 3HCl → AlCl3 + 3H2O Как кислота Al(OH)3 + NaOH
- 17. Соли алюминия Растворимы в воде Нерастворимые в воде: фосфаты Разлагаются водой: сульфиты, сульфиды Соли неустойчивых алюминиевых
- 18. Применение Al и его соединений В чистом виде алюминий находит применение из-за своей мягкости: из него
- 19. Сплавы алюминия используют в строительстве, т. к. из них легко изготовить различные профили балок и разные
- 20. Гель из гидроксида алюминия входит в состав лекарств для лечения болезней желудка. Гидроксид алюминия используется для
- 21. Применение сапфиров и рубинов
- 23. Скачать презентацию












 Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Кремний и его соединения
Кремний и его соединения Основные понятия и законы химии. Тема 1
Основные понятия и законы химии. Тема 1 Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Фосфаты и фосфонаты в стиральном порошке
Фосфаты и фосфонаты в стиральном порошке Электоролиз заңы
Электоролиз заңы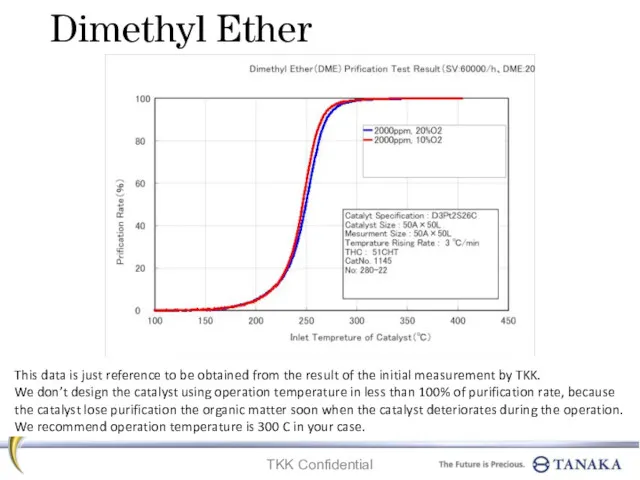 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result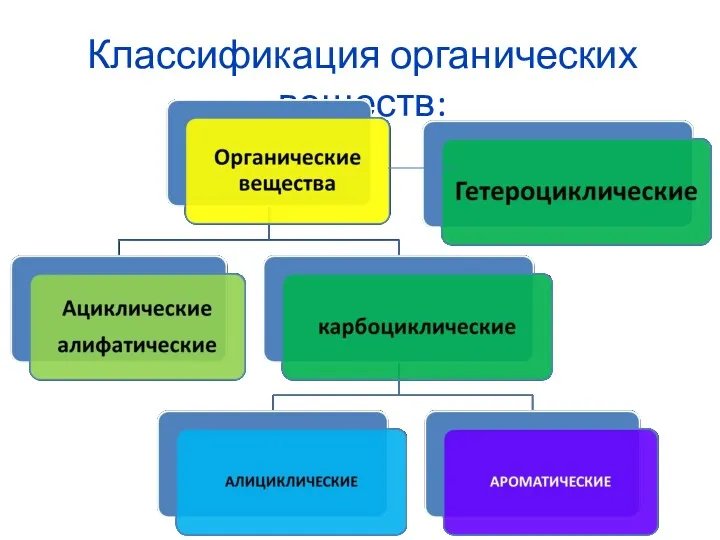 Классификация органических веществ
Классификация органических веществ Одноатомные спирты. Глицерин
Одноатомные спирты. Глицерин 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Горение жидкого топлива
Горение жидкого топлива Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 Аналитическая химия
Аналитическая химия Химические свойства алкенов
Химические свойства алкенов Вещества в твоей жизни
Вещества в твоей жизни Алкани
Алкани Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Чистые вещества и смеси
Чистые вещества и смеси Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Современные методы физико-химической биологии
Современные методы физико-химической биологии Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии